
科目: 来源:福建省三明一中2011届高三第二次月考化学试题 题型:058
实验室模拟合成氨和氨催化氧化的流程如下:

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
(1)从下图中选择制取气体的合适装置:氮气________、氢气________.

(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________、________.
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,________(“会”或“不会”)发生倒吸.
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:________.
(5)写出乙装置中氨氧化的化学方程式:________.
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、________、________离子.
查看答案和解析>>
科目: 来源:福建省南平市政和一中2011届高三上学期第二次月考化学试题 题型:058
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:浙江省杭州市西湖高级中学2010-2011学年高一上学期开学考试化学试题 题型:058
小刚、小军、小红对一久置的
NaOH白色粉末的成分进行探究并测定其成分的含量.(一)成分的确定
三位同学都作出以下的猜想:
①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物.
做出②③猜想的依据是________(用化学方程式表示)
为了验证①②③猜想,他们分别做了下面的实验.
(1)小刚取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有________,肯定猜想________(填序号)是错误的.
(2)小军又取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军结合小刚的实验,认为猜想③是正确的.小红却认为小军的所得结论不确切,因为________.
(3)为探究白色粉末是否含有NaOH,小红设计了如下实验方案:
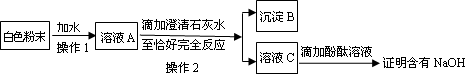
①沉淀
B的化学式为________.②在操作
1中要用到玻璃棒,其作用是________;在操作2中,除要用到铁架台(带铁圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是________.③小刚认为小红的这个方案也有问题,理由是
________.但只要稍加改进,就可以证明粉末中还含有NaOH,则小刚改进的方法是________.小刚对小红的实验作了正确的改进后进行了实验,实验现象和小红的一致,由此确定猜想③是正确的.(二)各成分含量的测定
三位同学利用电子天平共同作了以下测定实验.

实验数据记录如下:

(1)写出锥形瓶中发生反应化学方程式:________;________.
(2)试通过分析表中数据计算出混合物中试样中各成份的质量分数.
(三)实验反思:
有同学提出按上述实验所测得试样中
查看答案和解析>>
科目: 来源:四川省成都市玉林中学2011届高三九月诊断性评价化学试题 题型:058
电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:

请回答以下问题:
(1)操作a的名称是________,所用玻璃仪器有________;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)________溶液;
(3)写出固体H所含物质的化学式________;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的所有离子方程式________.
查看答案和解析>>
科目: 来源:安徽省合肥八中2011届高三第二次月考化学试题 题型:058
某无色溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成.取该溶液做如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到溶液.
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体A生成,同时析出白色沉淀甲;
③在②所得溶液中再加入过量Ba(OH)2溶液,也有气体B生成,并有白色沉淀乙析出.
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是________;一定存在的离子是________.可能存在的离子是________.
(2)写化学式:A:________;B:________;甲:________;乙中一定含________,可能含________.
(3)碳酸氢铵溶液与过量Ba(OH)2溶液反应的离子方程式:________.
查看答案和解析>>
科目: 来源:辽宁省本溪市高中2011届高三暑期补课阶段考试化学试题 题型:058
为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.

请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是________;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是________(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为________;
(4)当D中产生________(多选不得分)现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
装置D的作用为________
发生反应用化学方程式可表示为________.
查看答案和解析>>
科目: 来源:吉林省长春市十一高中2010-2011学年高一阶段考试化学试题 题型:058
已知某工业废水中含有大量
CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质.
(1)步骤1的主要操作是________,需用到的玻璃仪器除烧杯外有________.
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)________,固体残渣的成分是(填化学式)________.
(3)步骤3中涉及的操作是:蒸发浓缩、________、过滤、烘干.
(4)步骤2应该在通风橱中进行,原因是________.
查看答案和解析>>
科目: 来源:四川省成都外国语学校2011届高三10月月考化学试题 题型:058
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山西省山大附中2011届高三10月月考化学试题 题型:058
某活动课程小组拟用
50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程________、________.
此方案第一步的实验装置如下图所示:

(2)加入反应物前,如何检查整个装置的气密性________.
(3)装置B中盛放的试剂是________,作用是________.
(4)在实验室通常制法中,装置A还可作为下列________气体的发生装置(填序号).
①CH2![]() CH2
CH2
②H2S
③CH4
④CH≡CH
⑤H2
(5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内.

(6)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为________.
查看答案和解析>>
科目: 来源:辽宁省沈阳二中2011届高三10月月考化学试题 题型:058
某学生设计如下实验装置利用氯气与消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是________,所盛试剂是________.
(2)漂白粉将在U型管中产生,其化学反应方程式是________.
(3)有同学建议在两个橡皮套管内的玻璃管口应尽量紧靠,原因是________.
(4)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现主要原因是在U型管中存在两个副反应:①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,此副反应的化学方程式为:________,为避免此副反应的发生,可采取的措施是________.
②写出另一个副反应的化学方程式________.为避免此副反应发生,可采取的措施是________.
(5)在空气中,漂白粉会失效,原因是(用方程式表示)________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com