
科目: 来源:江苏省无锡市洛社中学2011-2012学年高二上学期期中考试化学试题(选修) 题型:058
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
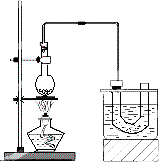
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10 mL 95%乙醇、28 mL 80%浓硫酸,然后加入研细的13 g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应.
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为:________.
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________,同时还生成另一种无色气体.
(3)U型管内可观察到的现象是________.
(4)反应结束后,U形管中粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的________(填字母)
A.NaOH溶液
B.H2O
C.Na2SO3溶液
D.CCl4
所需的主要玻璃仪器是________(填仪器名称).要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行________(填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后________(填代号).
①加热;
②加入AgNO3溶液;
③加入稀HNO3酸化;
④加入NaOH溶液;
⑤冷却
(6)
溴乙烷(C2H5Br)多一个碳的同系物所有可能的物质在氢氧化钠的醇溶液中能发生反应,写出该反应的化学方程式________,_________.查看答案和解析>>
科目: 来源:广东省揭阳一中2011-2012学年高一上学期第二次阶段考化学试题 题型:058
某学生课外活动小组,模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积.图中量气装置E由甲、乙两根玻璃管组成,它们由橡皮管连通,并装入适量水.甲管有刻度(0-50 mL),供量气用;乙管可上下移动调节液面高低.
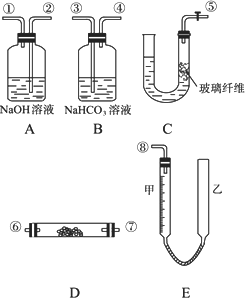
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水.
试完成下列问题:
(1)图中各装置接口连接顺序是________(填各接口的编号,其中连接胶管及夹持装置均省略).
(2)装置C中放入的反应物是________和________.
(3)装置D中发生的化学反应方程式________.
(4)装置A的作用是________,装置B的作用是________.
(5)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数及求其差值的过程中,应注意________和________(填字母编号).
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
(6)反应结束后,测得产生的气体标准状况下体积为22.4 mL,则反应过程中转移的电子数目为________.
查看答案和解析>>
科目: 来源:广东省中山一中2012届高三上学期第三次统测化学试题 题型:058
2011年8月12日,网上传云南曲靖市越州镇有总量5000余吨的重毒化工废料铬渣由于非法丢放,毒水被直接排放南盘江中.
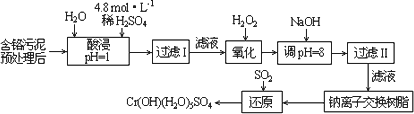
Ⅰ:某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
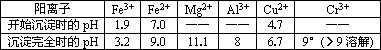
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需________.
(2)酸浸时,为了提高浸取率可采取的措施是________(至少答一点).
(3)加入H2O2的作用是________.
调节溶液的pH=8是为了除去________离子.
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是________.
(5)还原过程发生以下反应(请配平):
________Na2Cr2O7+________SO2+________=________Cr(OH)(H2O)5SO4+________Na2SO4;
Ⅱ:
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.阳极的电极反应式为________.在阴极附近溶液pH升高的原因是(用电极反应方程式解释)________.查看答案和解析>>
科目: 来源:浙江省瑞安中学2011-2012学年高二上学期期中考试化学理科试题 题型:058
Ⅰ.
已知:R-CH=CH-O-(
烃基烯基醚)烃基烯基醚A的相对分子质量(M r)为176,分子中碳氢原子数目比为3∶4.与A相关的反应如下:
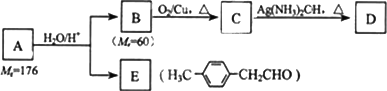
请回答下列问题:
(1)A的分子式为________.
(2)写出C→D反应的化学方程式:________.
(3)写出两种同时符合下列条件的E的同分异构体的结构简式:________、________.
①属于芳香醛;
②苯环上有两种不同环境的氢原子.
Ⅱ.由E转化为对甲基苯乙炔()的一条路线如下:
![]()
(4)写出G的结构简式:________和第④步反应的条件________.
查看答案和解析>>
科目: 来源:浙江省瑞安中学2011-2012学年高二上学期期中考试化学理科试题 题型:058
乳酸分子式为C3H6O3,在一定的条件下可发生许多化学反应,下图是采用化学方法对乳酸进行加工处理的过程.其中A、H、G为链状高分子化合物,已知F常做内燃机的抗冻剂.
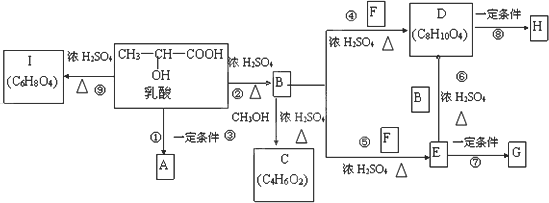
(1)请写出C结构简式为________;A的名称为________.
(2)B中所含的官能团名称________;反应⑦的反应类型是________.
(3)反应④的化学方程式为________.
(4)反应⑨的化学方程式为________.
查看答案和解析>>
科目: 来源:安徽省蚌埠铁中2012届高三上学期期中考试化学试题 题型:058
已知硝酸锏溶液颜色为蓝色
.某学校化学课外小组同学们在做铜与浓硝酸、稀硝酸反应的实验中,发现铜和浓硝酸反应后溶液为绿色旦有红棕色气体产生,而铜和稀硝酸反应后溶液为蓝色,产生无色气体.为弄清反应后溶液颜色出现差异的原因,他们进行了实验探究.实验:在两支试管中各放入一小块
等质量的铜片,分别加人等体积的浓HNO3(14 mol·L-1)和稀HNO3(4 mol·L-1),立即用蘸有NaOH的棉花封住试管口.充分反应后铜均无剩余.(1)Cu与浓HNO3反应的离子方程式________
(2)用蘸有NaOH的棉花封住试管口的原因________
已知NO2与NaOH溶液反应中,其中NO2的还原产物是亚硝酸盐(NO![]() )
)
写出反应的化学反应式________,
提出假设:假设一、因为铜离子浓度大造成的.
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.
设计实验方案,验证假设:
(3)上述实验________(“能”或“不能”)证明假设一不成立,原因________
(4)甲同学设计实验验证假设二,请帮他完成下表中内容(提示:NO![]() 在不同条件下的还原产物较复杂,有时难以观察到气体产生)
在不同条件下的还原产物较复杂,有时难以观察到气体产生)

分析推理:
(5)铜和稀硝酸反应后溶液为蓝色的原理________
查看答案和解析>>
科目: 来源:山东省潍坊市三县市2012届高三上学期期中联合考试化学试题 题型:058
为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0 g放入30.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
(1)甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)________________.
供选用试剂:a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.浓氨水
d.酸性KMnO4溶液
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案Ⅰ.取672 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g.
方案Ⅱ.向V mL c mol·L-1酸性高猛酸钾溶液中缓慢通入Y气体a L(标准状况),溶液恰好完全褪色.
方案Ⅲ,取V L(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg.
①其中不合理的方案是________,理由是________.
②选择合理方案的数据计算气体Y中SO2的体积分数(用含未知数的代数式表示)________.
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持装置已省略).

(3)装置A中试剂的作用是________.
(4)简述确认气体Y中含有CO2的实验现象:________.
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠?________(填“可靠”或“不可靠”),简述理由:________.
查看答案和解析>>
科目: 来源:陕西省师大附中2012届高三上学期期中考试化学试题 题型:058
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
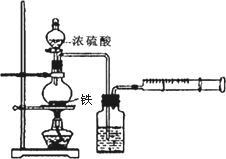
(1)实验目的:分析铁与浓硫酸在加热条件下的反应.
①洗气瓶中浓硫酸的作用是________.
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式________.
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验.
(2)实验目的:检验气体的成分.
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰.
仪器如下图(可重复使用,可根据需要取用);
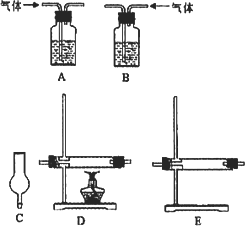
①连接仪器.将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是________.
(3)实验目的:确定产物的含量.
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有________.
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe2+可采用的试剂为________;如果该过程中共消耗了11.2 g铁,反应后的溶液能吸收标准状况下1.12 L氯气,则原溶液中含有Fe3+的物质的量为________mol.
查看答案和解析>>
科目: 来源:重庆市重庆一中2011-2012学年高一上学期期中考试化学试题 题型:058
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性.回答下列问题.
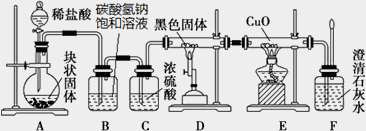
(1)写出装置A中发生反应的离子方程式:________.
(2)装置D中黑色固体为________(填名称),反应的化学方程式为:________.
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:________.
(4)按照如图装置进行实验时,首先进行的操作名称是________.
(5)根据实验中的________现象,可证明CO具有还原性,有关反应的化学方程式是________.
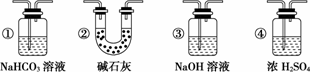
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的________装置(填序号).
查看答案和解析>>
科目: 来源:江苏省盐城中学2011-2012学年高二上学期期中考试化学试题(选修) 题型:058
50 mL 1.0 mol·L-1盐酸与50 mL 1.1 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.回答下列问题:
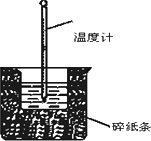
(1)从实验装置上看,大烧杯上没有________,会导致求得的中和热数值________(填“偏大”“偏小”或“无影响”);实验装置中还缺少环形玻璃搅拌棒,也会导致求得的中和热数值________(填“偏大”“偏小”或“无影响”);其中环形玻璃搅拌棒的作用为________.
(2)若实验中分多次把NaOH溶液倒入盛有盐酸的小烧杯中,则求得的中和热数值________(填“偏大”“偏小”或“无影响”).
(3)若实验中改用60 mL 1.0 mol·L-1盐酸跟60 mL 1.1 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”).
(4)若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”).
(5)若将V2 mL未知浓度的NaOH溶液加入盛有V1 mL 1.0 mol/L HCl溶液的小烧杯中,混合均匀后测量并记录溶液温度,且每次实验中均保持V1+V2=100 mL,实验结果如图所示(以温度为纵坐标,V1为横坐标).做该实验时起始环境温度________22℃(填<、=、>),NaOH溶液的浓度约为________mol/L.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com