
科目: 来源:浙江省杭师大附中2012届高三上学期第二次月考化学试题 题型:058
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为________;
在探究沉淀成分前,须将沉淀从溶液中分离并净化.其具体操作依次为________;
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分.
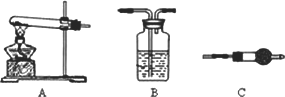
(1)各装置连接顺序为________;
(2)能证明生成物中有CuCO3的实验现象是________.
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成.
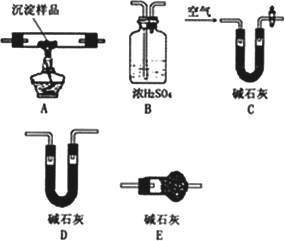
(1)装置C中碱石灰的作用是________,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是________
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为________.
查看答案和解析>>
科目: 来源:浙江省杭师大附中2012届高三上学期第二次月考化学试题 题型:058
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)以天然气为原料制H2是合成氨的一条重要的路线.甲烷的部分氧化,其反应式如下:
①CH4(g)+1/2O2(g)![]() CO(g)+2H2(g) ΔH1=-35.6 kJ·mol-1
CO(g)+2H2(g) ΔH1=-35.6 kJ·mol-1
试判断常温下,上述反应能否自发进行________(填“能”或“否”),有研究认为甲烷部分氧化的机理为:
②CH4(g)+2O2(g)![]() CO2(g)+2H2O(g)
CO2(g)+2H2O(g)
③CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
试结合反应①,确定下面热化学反应方程式中的ΔH值
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
(2)
恒温下,向一个2 L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
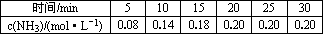
此条件下,该反应达到化学平衡时,氮气的浓度为________.
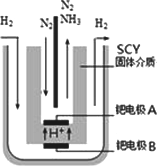
(3)希腊亚里斯多德大学的Marmellos和Stoukides用一种特殊的电解方法合成氨.即在常压下把氢气和用氦气稀释的氮气,分别通入到570℃的电解池中,用高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯多晶薄膜做电极,转化率高达78%.其实验装置如图.阴极的电极反应式________.
(4)用标准盐酸标定某氨水的浓度时应该选择下列哪种指示剂最好________.
A.甲基橙
B.石蕊
C.酚酞
查看答案和解析>>
科目: 来源:浙江省东阳中学2012届高三上学期期中考试化学试题 题型:058
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(Ⅱ):NO+FeSO4=Fe(NO)SO4
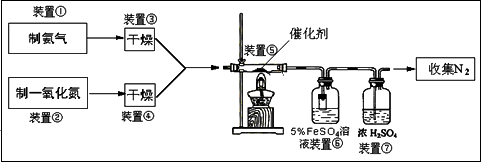
试回答下列问题:
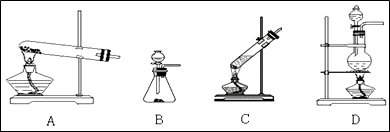
(1)实验室用氯化铵与氢氧化钙固体制备氨气,应选用的装置是________
该反应的化学方程式________
实验室通常用________法收集氨气,检验该气体是否收集满方法________
(2)装置③、④若用同一装置,则该装置中所盛装的药品是________
A.Na2O2
B.浓硫酸
C.P2O5
D.碱石灰
(3)装置⑥中,粗玻璃管X的作用________,装置⑦的作用________
(4)装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式________
(5)若参加反应的NO为2.688 L(标准状况,下同),氨气过量,最后收集到2.016 L N2,则装置⑤中NO的转化率为________
查看答案和解析>>
科目: 来源:浙江省东阳中学2012届高三12月阶段性检测化学试题 题型:058
三氯化铁是中学化学实验室中必不可少的重要试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒人蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体.
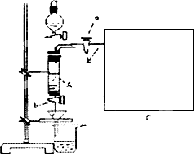
填写下列空白:
(1)如何检查装置A的气密性:________.
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与铁粉反应要快,其原因是________.
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由________.
(4)用该法制得的晶体中往往混有Fe(NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成________.
(5)若要测废铁屑的纯度,可测出从B处放出气体的体积,测量气体体积时,需待气体冷却至室温时进行,现有下列装置测定从B处放出气体的体积(忽略导管在量筒中所占的体积),应选用________(填序号),理由是________.
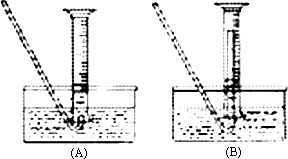
查看答案和解析>>
科目: 来源:浙江省东阳中学2011-2012学年高二上学期12月阶段性检测化学试题 题型:058
某实验小组用下列装置进行乙醇催化氧化的实验.
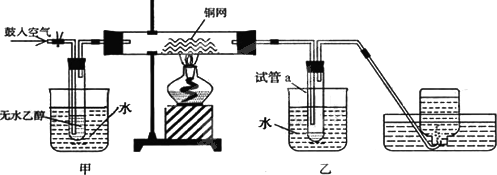
(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式
________、________.
(2)甲和乙两个水浴作用不相同.甲的作用是________;乙的作用是________
(3)反应结束后,要检验a中乙醇催化氧化的生成物,可加入________浊液并加热,写出该反应化学方程式________
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________.要除去该物质,可在混合液中加入________(填写字母).
a.氯化钠溶液
b.苯
c.碳酸氢钠溶液
d.四氯化碳
然后,再通过________(填试验操作名称)即可除去.
查看答案和解析>>
科目: 来源:河北省衡水中学2011-2012学年高二上学期四调考试化学试题 题型:058
某化学小组采用类似乙酸乙酯的装置(如下图)用环己醇制备环己烯.
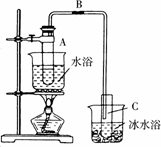
已知:![]()

(1)制备粗品将12.5 mL还已醇加入试管A中,再加入1 mL浓硫酸摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是________
②试管C置于冰水浴中的目的是________
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤.
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________口进入.蒸馏时要加入生石灰,目的是________

③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因________(填序号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
查看答案和解析>>
科目: 来源:江西省九江一中2011-2012学年高二上学期第二次月考化学试题 题型:058
某同学设计了如下图所示装置(部分夹持装置已略去)进行实验研究.
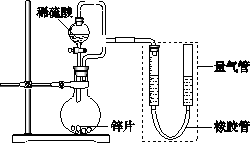
请回答:
(1)
用上述装置探究影响化学反应速率的因素.①圆底烧瓶中发生反应的离子方程式是________.
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2.

比较实验Ⅰ和Ⅱ可以得出的实验结论是
________.实验过程中,对量气管的操作是
________.③
若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是(填序号)________.a.石墨
b
.银c
.铜d
.沙粒(二氧化硅)(2)
用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.①
圆底烧瓶中的试剂可选用(填序号)________.a.NaOH溶液
b.C2H5OH
c.NaCl溶液
d.稀硫酸
②能证明
生铁在潮湿空气中会发生吸氧腐蚀的现象是________.查看答案和解析>>
科目: 来源:江西省九江一中2011-2012学年高一上学期第二次月考化学试题 题型:058
用下面两种方法可以制得白色的Fe(OH)2沉淀.
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入少量铁屑,目的是________;
(2)除去蒸馏水中溶解的O2常采用________的方法;
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是________.
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
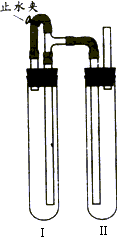
(1)在试管Ⅰ里加入的试剂是________;
(2)在试管Ⅱ里加入的试剂是________;
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________(填字母);
A.H2将空气中的氧气反应消耗了.
B.试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,外界空气不容易进入.
(4)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________.
查看答案和解析>>
科目: 来源:江苏省栟茶高级中学2012届高三上学期第二次调研测试化学试题 题型:058
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30 min,过滤.
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤.
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬.
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀.
⑤_________.
⑥_________.
⑦蒸发、冷却结晶并从溶液中分离出晶体.
⑧用少量乙醇洗涤并凉干.
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:_________.
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:_________.
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;
另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去.下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10?39).

下列说法正确的是_________(选填序号).
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_________.
(5)补充上述步骤⑤和⑥[可提供的试剂有6 mol/L的H2SO4溶液,蒸馏水、pH试纸].
查看答案和解析>>
科目: 来源:江苏省某重点中学2011-2012学年高二上学期12月练习化学试题 题型:058
在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g);ΔH=Q KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);ΔH=Q KJ/mol其化学平衡常数K和温度t的关系如下:
![]()
请回答:
(1)上述反应中Q________0(选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是________.
a.容器中压强不变
b.反应热不变
c.v正(H2)=v逆(CO)
d.CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:

①计算:3 min时CO的浓度c1=________mol/L,H2O(g)的转化率=________.
②反应在4 min~5 min之间,平衡向逆反应方向移动,可能的原因是________表中5 min~6 min之间数值发生变化,可能的原因是________.
a.增加水蒸气
b.降低温度
c.使用催化剂
d.增加氢气浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com