
科目: 来源:浙江省余姚中学2011-2012学年高二第一次质检化学试题(实验班) 题型:058
α-羟基苯乙酸俗称苦杏仁酸,是一种重要的医药中间体.其结构简式如图所示,广泛用做医药原料及染料中间体等.
甲同学设计了以下路线合成α-羟基苯乙酸:
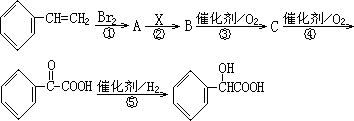
请回答下列问题:
(1)反应②使用的试剂X是________,其反应类型为________;
(2)物质C的结构简式是________;
(3)写出反应③的化学方程式________
(4)乙同学通过分析,认为甲同学设计的步骤⑤存在明显缺陷,你认为乙同学提出的缺陷是________;
(5)请设计反应流程图以苯乙烯为有机原料制备α-羟基苯乙酸:

说明1:合成反应流程图表示方法示例如下:
CH3CH2OH![]() CH3CHO……
CH3CHO……
说明2:Ⅰ.![]()
Ⅱ.CH3-CH=CH2![]() CH3-CH2-CH2Br
CH3-CH2-CH2Br
查看答案和解析>>
科目: 来源:福建省厦门六中2011-2012学年高一下学期期中考试化学试题 题型:058
A-E六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:

(1)工业上利用D单质与A的一种红色氧化物反应,在野外焊接钢轨,其化学方程式:________.
(2)分别由A、B、D、E所形成的简单离子中,具有还原性的离子是________,氧化性最弱的离子是________.(填离子符号)
(3)D的最高价氧化物对应水化物常用于治疗胃酸(含盐酸)过多症,请写出有关反应的化学方程式________.
(4)证明物质中含有E元素的方法是:用洁净的铂丝棒蘸取少量含E元素的物质在酒精灯上灼烧,能够观察到________色火焰.
(5)B与D形成的合金是工业上重要的材料.写出该合金在工业上的一个用途________.某同学仅使用天平和下图所示的装置测定某些数据即可求出该合金中B元素的含量.

①实验需要测定三个物理量:合金的质量m、a和b.
a是反应前装置和药品的总质量;
b是________;
②干燥管中盛放的试剂最好是________.
③合金中B元素的质量分数是________(用m、a、b表示).
查看答案和解析>>
科目: 来源:江西省上高二中2011-2012学年高一下学期第二次月考化学试题 题型:058
实验室模拟合成氨和氨催化氧化的流程如下:
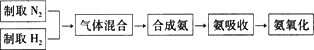
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.

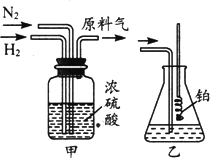
(1)从图中选择制取气体的合适装置:氮气和氢气分别为________和________.
(2)装置a中g管的作用是________;
(3)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________
________的作用.
(4)氨合成器出来经冷却的气体持续通入乙装置的水中吸收氨,________(填“会”或“不会”)发生倒吸,原因是________.
(5)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是________,锥形瓶中还可观察到的现象是________.
(6)写出乙装置中氨氧化的化学方程式:________.
查看答案和解析>>
科目: 来源:江苏省上冈高级中学2011-2012学年高二下学期期中考试化学试题 题型:058
孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
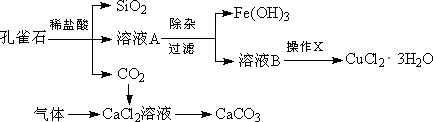
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
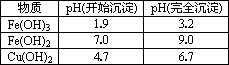
(1)“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,再加入CuO固体调节溶液的pH至________(填写范围).检验Fe(OH)3是否沉淀完全的实验方案是________.
(2)操作X包括________、________、过滤和洗涤等.CuCl2·3H2O加热灼烧的最终产物的化学式是________.
(3)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液各250 mL.
b.取0.1 g磨碎后的胃药于锥形瓶中.
c.向锥形瓶内加入25.00 mL 0.1 mol·L-1的HCl溶液.
d.以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,至达到滴定终点.
e.重复bcd三步的操作2次.
①操作c中量取盐酸体积的仪器是________.
②若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将________(选填“偏大”、“偏小”或“无影响”).
③若滴定中NaOH溶液的平均用量为15.00 mL,则胃药中碳酸钙的质量分数为________.
查看答案和解析>>
科目: 来源:湖北省公安三中2011-2012学年高二3月考试化学试题 题型:058
如图装置闭合电键K时,电流计A的指针将发生偏转.试回答:

(1)丙池是________(填“原电池”或“电解池”),甲中a极电极名称是________,丙中c极电极名称是________;
(2)乙中Cu极的电极反应是________,若电路中有0.02 mol电子通过,则甲中a电极溶解的质量为________g;
(3)闭合电键K一段时间后,丙池中生成二种气体和一种碱,则丙池中发生的总的化学方程式是________;
(4)丙池中反应进行较长时间后,收集到标准状况下氢气2.24 L此时测得丙池溶液质量实际减少4.23 g,含有碱0.100 mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是________mol;
(5)如果要给丙中铁片上镀上一层Cu,则丙池应作何改进________.
查看答案和解析>>
科目: 来源:甘肃省天水一中2011-2012学年高二下学期第一学段考试化学试题(兰天班) 题型:058
由短周期元素组成的化合物X是某抗酸药的有效成分.甲同学欲探究X的组成.
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝.
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液.
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5.6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
(1)Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是?________.?
(2)由Ⅰ、Ⅱ判断X一定不含有的元素是磷、________.
(3)Ⅲ中生成B的离子方程式是________.
(4)Ⅳ中B溶解的离子方程式是________.
(5)沉淀C的化学式是________.
(6)若上述n(A)∶n(B)∶n(C)=1∶1∶3,则X的化学式是________.
查看答案和解析>>
科目: 来源:四川省南山中学2011-2012学年高一下学期期中考试化学试题 题型:058
经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
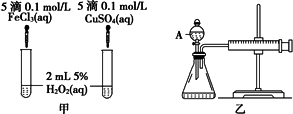
(1)定性分析:如图甲可通过观察________,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________,写出H2O2在二氧化锰作用下发生反应的化学方程式________.
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为________,实验中需要测量的数据是________.检查乙装置气密性的方法是________.
(3)0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________.
nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________.
(4)在一定温度下,反应:2A(s)+2B(g)![]() C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
A.容器内的压强不随时间而变化
B.混合气的密度不再随时间而变化
C.A的质量不再改变
D.平衡混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目: 来源:山东省济宁市鱼台二中2011-2012学年高一3月月考化学试题 题型:058
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.
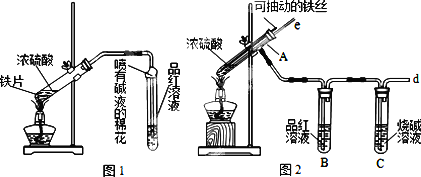
(1)比较两实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2,防止其污染环境;
②________.
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是________.
(3)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;
Ⅱ:只含有Fe2+;
Ⅲ:既有Fe3+又有Fe2+.
为验证Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀HCl溶液
B.稀H2SO4硫酸
C.KSCN溶液
D.KMnO4溶液
E.NaOH溶液
F.淀粉KI溶液
G.H2O2溶液
验证Ⅲ:步骤1.取试样,滴加少量的________(填试剂序号),溶液的颜色变________色,则试样中含有Fe3+.
步骤2.再取适量的试样滴加到少量的________(填试剂序号),观察到的现象为________,则试样中含有Fe2+.
查看答案和解析>>
科目: 来源:江西省赣州市十一县(市)2011-2012学年高二下学期期中联考化学试题 题型:058
下图是用来进行乙醇的氧化和检验氧化产物的实验装置.可供选择的试剂有:铜粉、氧化铜粉末、乙醇、新制氢氧化铜浊液、银氨溶液,所需要其它仪器任选.
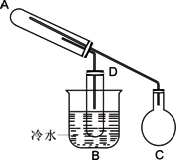
1.按照实验步骤,填写表格.

2.如何检查该装置的气密性:________.
3.C装置除了装反应药品外,为了防止意外,最好还要加些________.
4.反应后A试管中产生的现象是________,D试管中产生的现象________.
5.写出A、D试管中的化学反应方程式.
A________D________.
查看答案和解析>>
科目: 来源:浙江省嘉兴一中2011-2012学年高二下学期期中考试化学试题 题型:058
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:![]()
它所对应的化学反应为:________.
(2)已知在一定温度下,
C(s)+CO2(g)![]() 2CO(g)平衡常数K1;
2CO(g)平衡常数K1;
CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)![]() CO(g)+H2(g)平衡常数K3;
CO(g)+H2(g)平衡常数K3;
则K1、K2、K3之间的关系是:________.
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为:________.
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)![]() 2NO2(g) ΔH>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是________.
2NO2(g) ΔH>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是________.
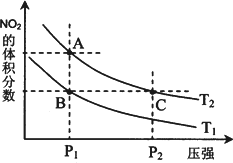
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2 mol/L的NaOH与0.4 mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是________.
(6)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式________,阳极区逸出气体的成分为________(填化学式).
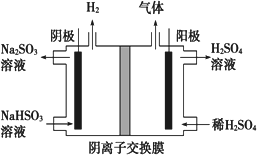
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com