
科目: 来源:山西省“晋商四校”2011-2012学年高二下学期联考化学试题 题型:058
[化学3-选修物质结构与性质]
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为________,其中心原子采取________杂化;化合物N在固态时的晶体类型为________.
(2)R、X、Y三种元素的第一电离能由小到大的顺序为________;
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为________(写分子式)
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质.该反应的离子方程式为________.
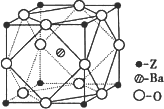
(5)Z原子基态时的外围电子排布式为________;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为________.
查看答案和解析>>
科目: 来源:山西省“晋商四校”2011-2012学年高二下学期联考化学试题 题型:058
氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨.下图是合成氨的简要流程.

(1)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.

①依据上表信息,你认为采用________为原料最好.
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:________.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式________.
(2)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
①依据表中数据判断,合成氨反应N2+3H2![]() NH3的△H________0(填“>”、“<”或“无法判断”),请简要说明理由________;
NH3的△H________0(填“>”、“<”或“无法判断”),请简要说明理由________;

②该反应的化学平衡常数表达式为________.
③在300℃、10 MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的________倍.
查看答案和解析>>
科目: 来源:山西省“晋商四校”2011-2012学年高二下学期联考化学试题 题型:058
某化学学习小组欲设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(预计H2的体积6 mL左右)同时检验氯气的氧化性.现有以下的仪器可供选择:

(1)若要完成以上的实验,将所给仪器连成一整套装置,各种仪器接口的连接顺序(填编号)是;A接________、________接________,B接________、________接________.
(2)能说明氯气具有氧化性的实验现象是________.
(3)已知氯气溶于水中有如下平衡:Cl2+H2O![]() HC1+HClO.
HC1+HClO.
常温下在一个容积为50 mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸入40 mL Cl2和10 mL H2O.

①若将此针筒长时间放置在有日光的地方,最终可能观察到的现象是________.
②用化学平衡的观点解释①的现象:________
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(标准状况)时停止通电.摇匀U形管内的溶液后溶液的pH约为________.
查看答案和解析>>
科目: 来源:广东省佛山一中2011-2012学年高一下学期期中考试化学试题 题型:058
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是∶________.
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
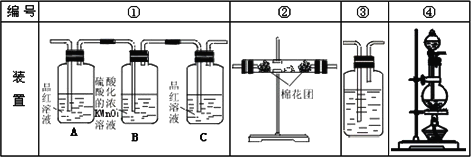
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号)∶________→________→________→________→________.
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是________,B瓶溶液的作用是________,C瓶溶液的作用是________.
(4)装置②中所加固体药品是________,可验证的产物是________,确定装置②在整套装置中位置的理由是________.
(5)装置③中所盛溶液是________,可验证的产物是________.
查看答案和解析>>
科目: 来源:广东省执信中学2011-2012学年高一下学期期中考试化学试题 题型:058
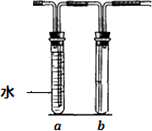
几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设计了如图所示的装置,在大试管里加入2 mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把产生的气体依次通入品红溶液和石蕊溶液中.

请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式:________.
(2)试管b中的现象是________,通过试管a、b的现象得出的结论是________.
(3)乙同学认为甲同学的设计不能全面体现SO2的性质,他打算增加试管进行其它实验.以下为增加的试管中盛放的试剂:
A.澄清石灰水
B.KMnO4(aq)
C.氢硫酸
请你帮助乙同学作出选择,在横线上先写出字母,再用文字简单说明实验的目的.
________________
(4)丙同学评价甲同学的实验装置既有优点也有不足,优点是________,不足之处改进的具体措施是________.
(5)若把上述装置中大试管的浓硫酸换成稀硝酸,试管a和b作如下改变(其中a装满水,b空置),则在大试管中发生的反应的离子方程式为________,试管a的作用是________________.
查看答案和解析>>
科目: 来源:广东省执信中学2011-2012学年高二下学期期中考试化学理科试题 题型:058
已知:①溴乙烷的沸点38.4℃
②NaBr+H2SO4(浓)![]() NaHSO4+HBr↑
NaHSO4+HBr↑
③2HBr+H2SO4(浓)![]() Br2+SO2↑+2H2O
Br2+SO2↑+2H2O
实验室制备溴乙烷(C2H5Br)的装置如图,步骤如下:

①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10 mL 95%乙醇、28 mL 78%浓硫酸,然后加入研细的13 g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应.
回答下列问题:
(1)实验用乙醇、浓硫酸、溴化钠制取溴乙烷的总的化学方程式为:________.
(2)反应时若温度过高,可看到有红棕色气体产生,该气体化学式为:________.
(3)为了更好的控制温度,除用图示的小火加热外,更好的加热方式为________.
(4)①反应结束后,U形管内粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可以选择下列试剂中的________(填字母),所需的主要玻璃仪器为________.
A.NaOH溶液
B.Na2SO3溶液
C.CCl4
②要进一步制得纯净的C2H5Br,可用水洗,然后________(填操作名称),再加入无水CaCl2,最后进行________(填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后________(填序号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
查看答案和解析>>
科目: 来源:四川省成都外国语学校2011-2012学年高一下学期期末考试化学试题 题型:058
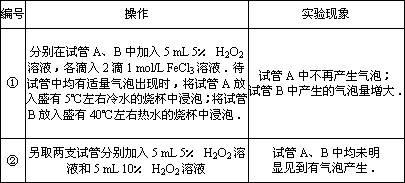
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为________.
(2)实验①的目的是________.
实验中滴加FeCl3溶液的目的是________.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是________(用实验中所提供的几种试剂).
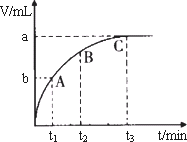
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是________.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察________,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是________.
查看答案和解析>>
科目: 来源:新疆乌鲁木齐市第八中学2011-2012学年高一下学期期中考试化学试题 题型:058
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的
生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实
验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气
体,记录获得相同体积的气体所需时间.

①请完成此实验设计,其中:V1=________,V6=________,V9=________.
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,
但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因________.
查看答案和解析>>
科目: 来源:新疆乌鲁木齐市第八中学2011-2012学年高一下学期期中考试化学试题 题型:058
a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;c与e同主族;a与c的最外层电子数之比为2∶3,b的最外层电子数比c的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞溶液变红.
(1)e的元素符号是________.
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为________,Z的化合物类型为________(填“共价化合物”或“离子化合物”).
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)________.
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为________.
查看答案和解析>>
科目: 来源:江西省高安中学2011-2012学年高二下学期期中考试化学试题 题型:058
按要求回答下列问题
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是________(填序号)
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用右图甲装置进行实验,试答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀.
②若开始时开关K与b连接,则总反应的离子方程式为________.
(3)已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
①铅蓄电池在放电时负极反应为________,
②铅蓄电池在充电时阳极反应为________;
③如果铅蓄电池在放电时回路中有2 mol电子转移时,消耗H2SO4________mol.
(4)常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)=________mol/L.
(5)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是________,只能电离不能水解的离子是________,既能电离又能水解的离子是________,写出能水解离子的水解离子方程式________,________.
(6)已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,测得某溶液的pH=13,则此温度下溶液中的c(Mg2+)=________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com