
科目: 来源: 题型:058
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如下图:
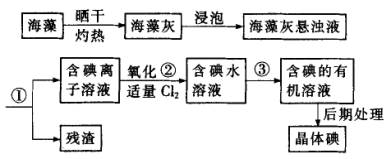
(1)指出提取碘的过程中有关的实验操作名称:①_____________,③_____________;写出过程②中有关反应的离子方程式_____________。
(2)提取碘的过程中,可供选择的有机试剂是________________。
A.甲苯、酒精
B.四氯化碳、苯
C.汽油、乙酸
D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出右边下图实验装置中的错误之处:①________,②________,③________。

(5)进行上述蒸馏操作时,使用水浴的原因是________________,最后晶体碘在________________里聚集.
查看答案和解析>>
科目: 来源: 题型:058
实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100℃左右时升华.下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示.试回答:

(1)B中反应的化学方程式为____________________________.
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是________________________.
(3)D中反应的化学方程式为__________________.
(4)装置(Ⅰ)的主要缺点是__________________.
(5)装置(Ⅱ)的主要缺点是__________________.如果选用此装置来完成实验,则必须采取的改进措施是_____________________________________________.
查看答案和解析>>
科目: 来源: 题型:058
浓盐酸与重铬酸钾(K2CrO7)共热能制出某有颜色的气体单质X,产物中还有三氯化铬(CrCl3)等生成。用这种方法制X的优点是加热则反应进行,撤灯则反应停止,便于控制出气的流量。现要制取纯净干燥的气体X,需要有提纯措施。现有下列装置如下图:

(1)加热时在a中的浓盐酸与重铬酸钾反应的化学方程式是________。
(2)液体c应使用什么试剂(写化学式表示溶质)________,其作用是________。
(3)液体d应是________________,其作用是________。现把制得的纯净干燥的X通入下图所示装置:在锥形瓶f里有紫黑色具金属光泽的晶体沉积。
(4)e中放入的白色钾盐________,反应时的化学方程式是________。

(5)g中盛有碱石灰它有两重作用是:
①________________________________________;
②________________________________________。
查看答案和解析>>
科目: 来源: 题型:058
欲测定金属镁的原子量.请利用下图给定的仪器组装一套实验装置(每件仪器只允许使用一次,假设各气体体积可看作是标准状况下测得).

填写下列各项(气体流向从左到右)
(1)各种仪器连接的先后顺序(用小写字母表示)应是________.
(2)连接好仪器后,要进行的操作有如下几步:
①待仪器B中的物质恢复至适当温度时,测得量筒C中水的体积为![]() ;
;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为mg,并将其投入试管B中的有孔隔板上;
③检查各装置的气密性;
④旋开仪器A上分液漏斗的活塞,使其中的水能顺利流下,当镁完全溶解时再关闭这个活塞,这时共在瓶A中放入水![]() .
.
上述操作的次序为(填序号)________.
(3)根据实验数据可算出金属镁的原子量,其数学表达式为________.
(4)若试管B的温度未冷却至室温,就测量量筒C中水的体积,这将会使所测原子量数据(填“偏高”、“偏低”、“无影响”)________;
(5)若未擦净镁条表面的氧化膜就进行实验,这将会使所测原子量数据(填“偏高”、“偏低”、“无影响”)______________.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:058
限使用下列试剂:酚酞、石蕊、氯化氨晶体、稀氨水、浓盐酸、醋酸铵晶体和蒸馏水.根据:(1)弱碱在水中存在电离平衡,(2)弱碱的阳离子会破坏水的电离平衡.这两平衡的移动都会引起指示剂颜色的变化,由此可分别选用上述试剂,设计两种实验证明氨水是弱碱,请简述实验方法及现象.
查看答案和解析>>
科目: 来源:福建省厦门市2012-2013学年高一下学期期末考试模拟试题(1)-化学 题型:058
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
[探究一]实验方案:铝镁合金![]() 测定剩余固体质量
测定剩余固体质量
问题讨论:(1)称取一定质量的铝镁合金粉末样品,加入过量的NaOH溶液,充分反应.实验中发生反应的化学方程式是________.
(2)过滤、洗涤、干燥、称量剩余固体.若未洗涤固体,测得镁的质量分数将________(填“偏高”或“偏低”).
[探究二]实验方案:铝镁合金![]() 测定生成气体的体积
测定生成气体的体积
实验装置:

问题讨论:(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置.你的意见是:________(填“需要”或“不需要”).
(2)为准确测定生成气体的体积,实验中应注意的问题是(只要求写出其中一点):________
[探究三]
实验方案:称量xg铝镁合金粉末,放在如下图所示装置的惰性电热板上,通电使其充分灼烧.

问题讨论:(1)欲计算Mg的质量分数,该实验中还需测定的数据是________.
(2)若用空气代替O2进行实验,对测定结果是否有影响?________(填“是”或“否”).
查看答案和解析>>
科目: 来源:福建省厦门市2012-2013学年高一下学期期末考试模拟试题(1)-化学 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省厦门市2012-2013学年高一下学期期末考试模拟试题(2)-化学 题型:058
推断题
A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质.它们之间的转化关系如下图所示:

请回答下列问题:
(1)B与甲反应的化学方程式是________.
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?________(填“是”或“否”).
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是________.
(4)写出A与水蒸气反应生成C和甲的化学方程式________.
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为nL,B与NaOH溶液反应的离子方程式是________,混合物中B的物质的量为________mol(用含字母的分数式表示).
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为mL,该反应中转移电子的物质的量为________mol,混合物中A的质量为________g(用含字母的分数式表示).
查看答案和解析>>
科目: 来源:福建省厦门市2012-2013学年高一下学期期末考试模拟试题(2)-化学 题型:058
下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置.其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放在脱脂棉.

试回答:
(1)A中所放试剂为________,B中所放试剂为________,此反应氧化剂是________;
(2)C中试剂是________;D中试剂的作用是________.
(3)E中现象是________;F中现象是________,其反应的化学方程式为________;F管中脱脂棉的作用是________;
(4)H中试剂为________,反应的离子方程式为________.
(5)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是________.
(6)若A中有14.6 gHCl被氧化,将产生的氯气通入足量的KI溶液中能产生单质碘的质量为________g.
查看答案和解析>>
科目: 来源:绥化二中高一期末化学试题(理) 题型:058
下面是甲、乙、丙3位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关的实验任务
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙3位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯.
[装置设计]甲、乙、丙3位同学分别设计了下列3套实验装置:

若从甲、乙两位同学设计的装置中选择1套作为实验室制取乙酸乙酯的装置,应该选择的装置是________(填“甲”或“乙”).丙同学将甲装置中的玻璃导管改成了球形干燥管,除起导气和冷凝作用外,另一个重要的作用是________.
[实验步骤]
a.按所选择的装置组装仪器,在试管①中先加入3 mL 95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸,充分摇匀,冷却后再加入2 mL冰醋酸;
b.将试管固定在铁架台上;
c.在试管②中加5 mL饱和Na2CO3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象停止实验.
[问题讨论]
(1)步骤a中组装好实验装置后,加入样品前还应检查________.
(2)试管②中装有饱和Na2CO3溶液,其作用是________(填字母).
A.吸收乙醇
B.中和乙酸
C.乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)根据试管②中观察到的现象,可知乙酸乙酯的物理性质有________;
(4)写出制乙酸乙酯的化学方程式________;
(5)写出把制得的乙酸乙酯分离出来的方法________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com