
科目: 来源: 题型:022
现有甲、乙、丙、丁四种晶体的晶胞,如图所示:

甲中X处于晶胞中心;乙中a处于晶胞中心;丙中A处于晶胞中心,B处于棱,C处于顶点,由此可知:
(1)甲晶体中X和Y的个数比是______;乙晶体中a与b的个数比_____,丙的分子式是______,丁晶体中每个晶胞有______个c离子,有______个d离子.
(2)若乙的边长为m,晶体的密度为ρ,则它的摩尔质量为______.
查看答案和解析>>
科目: 来源: 题型:022
有A、B、C、D四种元素.已知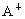 的原子核外没有电子,B原子的最外层电子数是次外层电子数的3倍;B原子、C原子、
的原子核外没有电子,B原子的最外层电子数是次外层电子数的3倍;B原子、C原子、 的电子层数相同,常见的C单质是黑色固本,B、C、D元素可形成
的电子层数相同,常见的C单质是黑色固本,B、C、D元素可形成 型和
型和 型化合物,试回答:
型化合物,试回答:
(1)写出这四种元素原子的电子式:
A______,B______,C______,D______.
(2)写出 与
与 反应的化学方程式:__________________________.
反应的化学方程式:__________________________.
(3)写出A、B、D三种元素形成的化合物与 发生反应的化学方程式:____________________________________.
发生反应的化学方程式:____________________________________.
(4)由A、B、D三种元素所形成化合物的电子式为______,该化合物属于______晶体; 分子的电子式为______,它属于______晶体,俗称______.
分子的电子式为______,它属于______晶体,俗称______.
查看答案和解析>>
科目: 来源: 题型:022
(2005·江苏)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热( ),化学反应的
),化学反应的 等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.

请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”“<”)SiC________Si; ________
________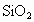 .
.
(2)图中立方体中心的“·”表示硅晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的硅原子.

(3)工业上高纯硅可通过下列反应制取:
该反应的反应热 =_________
=_________
查看答案和解析>>
科目: 来源: 题型:022
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族;B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.根据以上信息,回答下列问题:

(1)A和D氢化物中,沸点较低的是______(选填“A”和“D”);A和B的离子中,半径较小的是______(填离子符号)
(2)元素C在元素周期表中的位置是______.
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“·”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心.该化合物的电子式是______.
”表示)均位于小正方体中心.该化合物的电子式是______.
查看答案和解析>>
科目: 来源: 题型:022
图为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位.
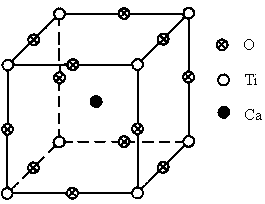
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有______个.
(2)该晶体结构中,元素氧、钛、钙的离子个数比是______,该物质的化学式可表示为______.
(3)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm( ),则该晶体的密度为______
),则该晶体的密度为______ .
.
查看答案和解析>>
科目: 来源: 题型:022
晶体中最基本的重复单位称为晶胞.NaCl晶体结构如图所示.已知 晶体晶胞结构为NaCl型,由于晶体缺陷,x取值小于1.测知
晶体晶胞结构为NaCl型,由于晶体缺陷,x取值小于1.测知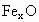 晶体密度为
晶体密度为 ,晶胞边长为4.28*10-10m
,晶胞边长为4.28*10-10m

(1) 中x值(精确至0.01)为______.
中x值(精确至0.01)为______.
(2)晶体中的Fe分别为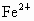 、
、 ,在
,在 和
和 的总数中,
的总数中, 所占分数(用小数表示,精确至0.001)为______.
所占分数(用小数表示,精确至0.001)为______.
(3)此晶体化学式为_______________________.
(4)与某个 (或
(或 )距离最近且等距离的
)距离最近且等距离的 围成的空间几何形状是______.
围成的空间几何形状是______.
(5)在晶体中,铁元素的离子间最短的距离为______m.
查看答案和解析>>
科目: 来源: 题型:022
随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中.
②用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为 .
.
(1)步骤①中A仪器最好用___________(仪器名称).
(2)步骤②中用酸式滴定管好还是碱式滴定管好,___________,理由是_____________________________________.
(3)能否用胶头滴管代替步骤②中的滴定管___________,理由是_______________________________________.
(4)能否用水代替苯___________,理由是___________.
(5)已知NaCl晶体的结构如图所示,用X射线测得NaCl晶体中靠得最近的 与
与 间的平均距离为a cm,则用上述测定方法测得阿伏加德罗常数
间的平均距离为a cm,则用上述测定方法测得阿伏加德罗常数 的表达式为
的表达式为 =______.
=______.

查看答案和解析>>
科目: 来源: 题型:022
参考下表中物质的熔点,回答有关问题

(1)钠的卤化物及碱金属的氯化物的熔点与______有关,随着______增大,______减小,故熔点依次降低.
(2)硅的卤化物及锗、锡、铅的氯化物的熔点与______有关,随着______增大,______增大,故熔点依次升高.
(3)钠的卤化物的熔点比相应的硅卤化物的熔点高得多,这与______有关,因为______,故前者的熔点远远高于后者.
查看答案和解析>>
科目: 来源: 题型:022
(2004·烟台)在离子晶体中,阴、阳离子按一定规律在空间排列,下图A是NaCl的晶体结构,在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以被看作是不等径的刚性圆球,并彼此相切如NaCl晶体结构如图B,已知a为常数.

(1)在NaCl晶体中,每个 同时吸引_______个
同时吸引_______个 ;而
;而 数目和
数目和 数目之比为_______.
数目之比为_______.
(2) 半径与
半径与 半径之比
半径之比 =______________(已知
=______________(已知 ).
).
(3)NaCl晶体中不存在分子,但在 ,1 413℃时,NaCl晶体形成气体,并以分子形式存在.现有29.25g NaCl晶体,在
,1 413℃时,NaCl晶体形成气体,并以分子形式存在.现有29.25g NaCl晶体,在 时强热使温度达到1 501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(化学式)为______(不写计算过程).
时强热使温度达到1 501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(化学式)为______(不写计算过程).
(4)若 ,求NaCl晶体的密度(已知
,求NaCl晶体的密度(已知 ,NaCl的摩尔质量为
,NaCl的摩尔质量为 ).
).
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
计算以下两小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式.
(1)在温度为t℃和压强p Pa的情况下,19.5g A与11.0g B恰好完全反应,生成固体C和3.00L的D气体,计算生成的C的质量(m).缺少的数据是________,计算式为m=________.
(2)0.48g金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积[V(H2)].缺少的数据是________,计算式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com