
科目: 来源: 题型:022
高分子化合物A和B的部分结构如下:
A.
B.
(1)高分子化合物A是由单体________(填结构简式)经________反应(填反应类型)生成的。
(2)高分子化合物B是由单体________(填结构简式)经________反应(填反应类型)生成的。
查看答案和解析>>
科目: 来源: 题型:022
已知,葡萄糖在乳酸菌的催化作用下可转化为乳酸(C3H6O3)。
(1)下图中能够说明运动员在短跑从开始到结束后血液乳酸浓度变化的曲线是________。
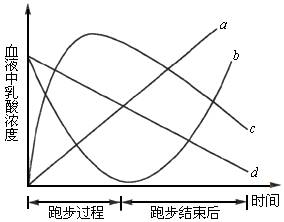
(2)人体剧烈运动后,往往会感到肌肉酸痛,其原因是肌肉中________。
(3)取9.0g乳酸与足量金属钠反应,可产生2.24L气体(标准状况)。另取9.0g乳酸与等物质的量的乙酸反应,生成0.01 mo1乳酸乙酯和1.8g H2O。乳酸在铜作催化剂时,可氧化生成物质X,向X中加入碱和银氨溶液微热,无银镜产生。由以上实验可确定X的结构简式是________,乳酸的结构简式是________。
(4)近年来,乳酸成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。利用乳酸聚合而成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中,都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
①写出乳酸在一定条件下发生缩聚反应的化学方程式:________________。
②用乳酸聚合纤维(聚乳酸)非常适合于做手术缝合线,尤其是做人体内部器官的手术,试分析其中的原因________________________。
③试从生物学物质循环的角度解释利用乳酸合成高分子材料,对于环境有什么重要的意义?________________________________。
查看答案和解析>>
科目: 来源: 题型:022
已知:①卤代烃(R—X,R表示烃基,X表示Cl、Br、I等卤素原子)与Mg在乙醚中反应可生成著名的“格氏试剂”。
②格氏试剂广泛用于有机合成,如在一定条件下能与醛中的羰基(![]() )发生加成反应:
)发生加成反应:
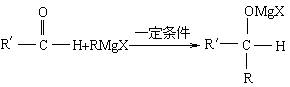
上述反应的生成物又可以发生水解反应生成醇:
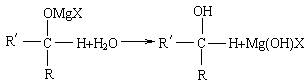
因此常用醛和卤代烃来合成醇。现要合成醇:
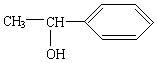 回答下列问题:
回答下列问题:
(1)所用的醛和卤代烃分别是什么?(写结构简式)
醛:________________,卤代烃:________________
(2)现有苯、乙烯、Cl2、Mg、乙醚、H2O、O2等物质(所用催化剂不在此列,可按你的需要另外选用),请写出合成上述醇的各步反应的化学方程式。
________________________________________________
查看答案和解析>>
科目: 来源: 题型:022
在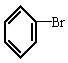 与NaOH的醇溶液共热一段时间后,要证明
与NaOH的醇溶液共热一段时间后,要证明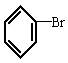 已发生反应,甲、乙、丙三名学生分别选用了不同的试剂和方法,都达到了预期的目的。请你写出这三组不同的试剂名称及每种试剂的作用。
已发生反应,甲、乙、丙三名学生分别选用了不同的试剂和方法,都达到了预期的目的。请你写出这三组不同的试剂名称及每种试剂的作用。
查看答案和解析>>
科目: 来源: 题型:022
录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe3-xO3+x的化合物。已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价,则x值为________,铁的化合价为________,钴的化合价为________。
查看答案和解析>>
科目: 来源: 题型:022
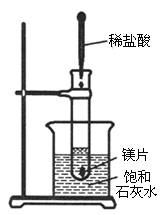
(1)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
①实验中观察到的现象是_______________________。
②产生上述现象的原因是_______________________。
③写出有关反应的离子方程式____________。
④由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(2)城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭与水蒸气在高温下反应制得,故又称水煤气。试解答:
①写出制取水煤气的主要化学方程式____________。该反应是____________反应(填吸热、放热)。
②设液化石油气的主要成分为丙烷(C3H8),其充分燃烧后产物为CO2和H2O。试比较完全燃烧等质量的C3H8及CO所需的氧气的体积比(同温、同压下)为:____________。
③氢气是未来的能源,燃烧时除产生热量外,还具有的优点是____________。
④使用管道煤气必须防止因煤气泄漏而引起的中毒和爆炸。某住房因煤气泄漏而发生爆炸事故。
调查发现煤气是在达到室内空气质量的6%时发生爆炸的,该住户煤气泄漏速度为0.6g/min,问爆炸时煤气已泄漏约________小时(假设厨房体积为25m3,空气密度约为1.29g/L)。
查看答案和解析>>
科目: 来源: 题型:022
一支干燥的小试管中,装有少量的白色物质(约占试管容积的1/10),已知该白色物质是碳酸氢氨、碳酸氢钠、碳酸钠和氯化钠中的一种,现通过加热试管中的固体,只用蒸馏水、石蕊试纸或pH试纸进行鉴定。
(1)①按照顺序写出主要实验步骤及操作要点(使用酒精灯和试管夹的方法不必叙述,其他要点说清楚)_________________________________________________________________ .
②石蕊试纸或pH试纸的作用是________________________________。
③蒸馏水的作用是__________________________________________。
(2)填写下表:
白色物质 判断依据的现象 有关化学方程式(或离子方程式)
碳酸氢铵
碳酸氢钠
碳酸钠
氯化钠
查看答案和解析>>
科目: 来源: 题型:022
有下列实验操作供选用:
①加NaOH溶液,②加盐酸,③加硝酸,④加热,⑤加硝酸银溶液,⑥加水过滤,⑦加二氧化锰,⑧久置于空气中
(1)证明一种金属粉末是铁粉,操作的顺序是________。
(2)证明氯酸钾中含有氯元素,操作的顺序是________。
(3)证明2-碘戊烷中含有碘元素,操作的顺序是________。
查看答案和解析>>
科目: 来源: 题型:022
已知:氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)ƒCa2++2OH-。
在火力发电厂燃烧煤的废气中往往含有SO2,O2,N2,CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物均为石膏。
(1)写出上述两个反应的化学方程式:
①SO2与CaCO3悬浊液反应:________;
②SO2与Ca(OH)2悬浊液反应:________。
(2)试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由:________。
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度。在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建造高烟囱的结果,地面浓度降低了30%之多。
请你从全球环境保护的角度,分析这种方法是否可取?________简述其理由:________。
查看答案和解析>>
科目: 来源: 题型:022
硫酸最古老的生产方法是把绿矾装入反应器中加强热,会流出油状液体即硫酸,故硫酸又叫绿矾油。并放出有刺激性气味的气体,反应器中的固体变为红色。这个过程可用两个化学方程式表示:
(1)___________________________________;
(2)___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com