
科目: 来源:山东省济南外国语学校2011-2012学年高二上学期期中考试化学理科试题 题型:022
如图所示,若电解5 min时铜电极质量增加2.16 g,试讨论

(1)电源电极X名称为________.
(2)pH变化:A________,B________,C________.
(3)通过5 min时,B中共收集224 mL气体(标况),溶液体积为200 mL,则通电前硫酸铜溶液的物质的量浓度为________.
(4)若A中KCl溶液的体积也是200 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是________.
查看答案和解析>>
科目: 来源:山东省济南外国语学校2011-2012学年高二上学期期中考试化学理科试题 题型:022
如下图,a、b是石墨电极,Z是滴有酚酞的饱和氯化钠溶液,通电一段时间后,在a棒附近看到颜色变红明显,则电源y是________极,实验过程中还能观察到的现象是________,a棒发生的电极反应式为________,b棒电极反应式为________.

查看答案和解析>>
科目: 来源:甘肃省天水市一中2012届高三上学期第三次段考化学理科试题 题型:022
已知周期表中,元素Q、R、W、Y与元素X相邻.Y的最高化合价氧化物的水化物是强酸.回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料.W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是________;
(2)Q的具有相同化合价且可以相互转变的氧化物是________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)________,其原因是________;
②电子总数相同的氢化物的化学式和立体结构分别是________.
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料.上述相关反应的化学方程式(各物质用化学式表示)是________
查看答案和解析>>
科目: 来源:浙江省诸暨中学2011-2012学年高二上学期期中考试化学理科试题 题型:022
25℃时,0.1 mol·L-1 HA溶液pH=2,0.1 mol·L-1 HB溶液pH=3.
(1)前者大于后者的是________(多选、错选均不给分,下同);
①HA、HB的电离平衡常数
②HA、HB的电离度
③溶液中的c(OH-)
④溶液的导电性
⑤溶液中由水电离出的c(H+)
(2)若HA、HB溶液的pH相同、体积相等,前者小于后者的是________;
①HA、HB物质的量浓度
②同时加入足量的锌,开始反应时速率
③同时加入足量的锌,反应完全后生成H2的质量
④二种酸溶液的导电能力
⑤用1 mol/L NaOH溶液分别中和二种酸,消耗NaOH溶液体积
⑥将这两种溶液分别稀释10倍后溶液的pH.
(3)若中和体积为Va浓度为0.1 mol·L-1 HA溶液,消耗0.1 mol·L-1 NaOH溶液的体积为Vb,且Va>Vb,下列说法一定正确的是________.(提示:CH3COONa溶液呈碱性)
①混合后溶液呈中性
②混合后溶液呈酸性
③混合后溶液呈碱性
④混合后溶液中的溶质为
NaA⑤混合后溶液中的溶质为
NaA和HA⑥混合后溶液中的溶质为
NaA和NaOH查看答案和解析>>
科目: 来源:浙江省诸暨中学2011-2012学年高二上学期期中考试化学理科试题 题型:022
在容积为VL的密闭容器中发生2NO2![]() 2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.
2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.

(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是________.
A.有、无催化剂
B.温度不同
C.压强不同
D.V值不同
(2)写出该反应的化学平衡常数K的表达式:________,并比较K800℃________K850℃(填“>”、“<”或“=”).
(3)在图上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)=________.
(4)不能说明该反应已达到平衡状态的是________.
A.v正(NO2)=v逆(NO)
B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变
D.气体的密度保持不变
(5)在如图所示的三个容积相同的三个容器①、②、③进行反应:2NO+O2![]() 2NO2
2NO2
若起始温度相同,分别向三个容器中充入2 mol NO和1 mol O2,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号)________.
查看答案和解析>>
科目: 来源:浙江省诸暨中学2011-2012学年高二上学期期中考试化学理科试题 题型:022
如图所示,U形管内盛有100 mL的溶液,按要求回答下列问题:

(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为________极,A极的电极反应式为________.若所盛溶液为KCl溶液:则B极的电极反应式为________,K+移向________极(填A、B)
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是________.
②B电极上的电极反应式为________,总反应化学方程式是________.
③反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2 mL,将溶液充分混合,溶液的pH约为________.若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的________.
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是________,电极反应式是________,反应一段时间后电解质溶液中Cu2+浓度________(填“增大”、“减小”、“不变”).
查看答案和解析>>
科目: 来源:江西省教育学院附中2012届高三11月月考化学试题 题型:022
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是________
(2)X与W组成的化合物中存在________键(填“离子”“共价”).
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为________.
(4)由X、Y、Z、W四种元素组成的一种离子化合物A.
①已知1 mol A能与足量NaOH浓溶液反应生成标准状况下44.8 L气体.写出加热条件下A与NaOH溶液反应的离子方程式________
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:________.
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6 mol结晶水.对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;
B.B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为________.
②已知1 mol·L- 1100 mL B的溶液能与1 mol·L- 120 mL KMnO4溶液(硫酸酸化)恰好反应.写出反应的离子方程式________.
查看答案和解析>>
科目: 来源:江西省上高二中2011-2012学年高二第二次月考化学试题(普通班) 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省南安一中2012届高三上学期期中考试化学试题 题型:022
1 L
某混合溶液,可能含有的![]()
(1)
往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
则该溶液中确定含有的离子有________;不能确定是否含有的阳离子有________,要确定其存在可补充做的实验是________;
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的![]() 关系如下表所示,分析后回答下列问题:
关系如下表所示,分析后回答下列问题:
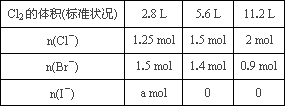
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为________.
②原溶液中Cl-、Br-、I-的物质的量浓度之比为________.
查看答案和解析>>
科目: 来源:宁夏中卫市海原一中2011-2012学年高二第一学段考试化学试题 题型:022
已知水在25℃和95℃时,其电离平衡曲线如图所示:
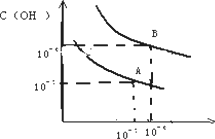
(1)则25℃时水的电离平衡曲线应为 ________(填“A”或“B”)
(2)25℃时,将PH=9的NaOH溶液与PH=4的H2SO4溶液混合,若所得混合溶液的PH=7,则NaOH溶液与H2SO4溶液的体积之比为________.
(3)95℃时,若100体积的PH1=a的某强酸溶液与1体积PH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的PH1与强碱的PH2之间应满足的关系是________.
(4)曲线B对应温度下,PH=2的HCL溶液和PH=10的某MOH溶液等到体积混合后,混合溶液的PH=7.请分析原因:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com