
科目: 来源:福建省福州市罗源一中2010-2011学年高二第一次月考化学试题 题型:022
X
、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.
请回答:
(1)Z2Y的化学式是________,
(2)如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成.一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.此时:
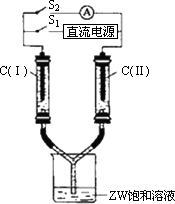
C(Ⅰ)的电极名称是________(填写正极或负极);电极反应式是:________;
C(Ⅱ)的电极反应式是________.
(3)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是:________.
查看答案和解析>>
科目: 来源:浙江省温州市2011届高三八校联考化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:广东省高州一中2009-2010学年高二学科竞赛化学试题 题型:022
现有含烃基R-的有机物R-OH,该物质遇FeCl3溶液显紫色,其蒸气的密度是相同状况下氢气的47倍.
工业上ROH可由如下途径获得:请回答
:(1)反应①的化学方程式为________,反应类型________.
(2)反应②中,每生成1 mol RONa,需要消耗NaOH________mol.
(3)
有机物W(C7H8O)与ROH互为同系物,任写一种W可能的结构简式________.(4)已知醇Z与W互为同分异构体,且Z有如下的转化关系.
经测定,B分子中只含有如下结构片段各1个:
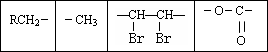
①B的分子式为________;
②Z和D生成A的方程式为:________;
③有机物甲与D“结构相似,分子组成比D多2个CH2原子团”,且分子中除了饱和烃基与D不同外,其余部分都与D相同.写出甲可能的结构简式:________.
查看答案和解析>>
科目: 来源:2010年高一“每周一练”系列(15)化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:浙江省温州中学2011届高三年级上学期10月月考化学试题 题型:022
1 L某混合溶液,可能含有的离子如下表:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
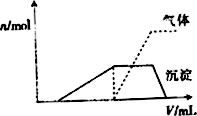
则该溶液中确定含有的离子有________;
不能确定是否含有的阳离子有________,
要确定其存在可补充做的实验是________;
肯定不存在的阴离子有________.
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入-定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
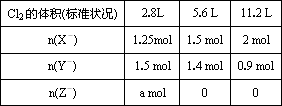
①a=________;
②当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为________.
③原溶液中Cl-、Br-、I-的物质的量浓度之比为c(Cl-)∶c(Br-)∶c(I-)=________.
查看答案和解析>>
科目: 来源:学习高手必修二化学鲁科版 鲁科版 题型:022
紫杉醇是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯.
A:![]() (C6H5-是苯基)
(C6H5-是苯基)
B:R-OH(R是一个含C、H、O的基团)
(1)A可在无机酸催化下水解,其反应方程式是________.
(2)A水解所得的氨基酸不是天然蛋白质水解产物,因为氨基不在(填希腊字母)________位.
(3)写出ROH的分子式.
查看答案和解析>>
科目: 来源:河南省清丰一高2009-2010学年高二上学期期末考试化学试题 题型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:河南省焦作市2009-2010学年高二上学期期末考试化学试卷 题型:022
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
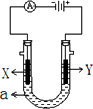
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为________.
在X极附近观察到的实验现象是________.
②Y电极上的电极反应式为________.
③总反应方程式:________;
(2)若要在铁制品上镀一定厚度的银层
①X电极材料是________(填铁或银);
②a是________溶液
③Y电极反应方程式:________;
(3)若X、Y都是铂电极,电解某金属的氯化物(XCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g.
①该金属的相对原子质量是________;
②电路中有________mol电子通过.
查看答案和解析>>
科目: 来源: 题型:022
氧化铝有二种变体,一种是a-Al2O3,另一种是g-Al2O3,g-Al2O3可用Al(OH)3在723K时加热制得,它不耐酸;a-Al2O3是天然刚玉的主要成分,硬度很高,且对酸有极强稳定性。a-Al2O3,可以用g-Al2O3于高温煅烧制得,已知氧化铝可由铝铵明矾加热制得,铝铵明矾[NH4Al(SO4)2×12H2O]受强热分解的产物为Al2O3、NH3、N2、SO3、SO2和H2O。
(1)写出铝铵明矾强热分解反应的化学方程式____________,在此反应中氧化产物与还原产物的物质的量之比为_________。
(2)把上述反应中的Al2O3加入适量氧化铬在氢氧焰上强热熔融后,使其结晶可以制成人造红宝石,可用于作激光器材和装饰品。所得人造红宝石是哪种Al2O3的变体?_____________,怎样用简便方法说明它确实是该种Al2O3的变体?________________。
(3)氧化铝陶瓷是一种重要的结构材料,工业上用它来制造坩埚、高温炉管,是利用它的__________特性;用它制造刚玉球磨机,是利用它的________特性。
查看答案和解析>>
科目: 来源: 题型:022
物质A是一种高熔点的化合物,不溶于硫酸、硝酸等强酸。A在一定条件下可发生如下变化:

完成以下各项:
(1)写出化合物A、B、C、D的化学式;
(2)写出上述一系列变化的化学方程式;
(3)化合物A能溶于何种酸?这在工业生产上有何实际意义?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com