
科目: 来源:山东省梁山一中2010-2011学年高二下学期期末考试化学试题 题型:022
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液.电极均为石墨电极.
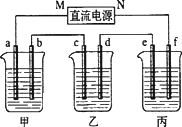
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为________;
③列式计算电极b上生成的气体在标准状况下的体积:________;
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液________;
乙溶液________;
丙溶液________;
(2)如果电解过程中铜全部析出.此时电解能否继续进行,为什么?__________.
查看答案和解析>>
科目: 来源:选修高手化学人教·有机化学基础 人教版 题型:022
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.
(1)A的结构简式为________;
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体.

反应②的化学方程式为________;C的化学名称是________;E2的结构简式是________;④⑥的反应类型依次是________.
查看答案和解析>>
科目: 来源:四川省绵阳中学2011届高三化学考前热点训练:14工艺流程、无机综合题 题型:022
稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:

已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:

②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为________.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、________(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液
b.氨水
c.CO2气
d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:________.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在________的范围内;检验Fe3+是否沉淀完全的操作方法是________.
查看答案和解析>>
科目: 来源:四川省绵阳中学2011届高三化学考前热点训练:14工艺流程、无机综合题 题型:022
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
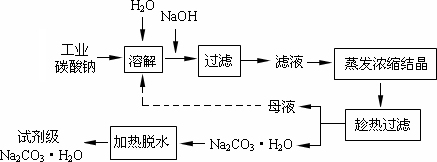
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ、25℃时有关物质的溶度积如下(物质溶解时溶液中其电离的离子浓度的乘积):

回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为________.
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=________.
(2)“趁热过滤”时的温度应控制在________.
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用.请你分析实际工业生产中是否可行________,并说明理由________.
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ·mol-1 Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63 kJ·mol-1写出Na2CO3·H2O脱水反应的热化学方程式________.
查看答案和解析>>
科目: 来源:四川省绵阳中学2011届高三化学考前热点训练:14工艺流程、无机综合题 题型:022
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1 L.
(1)160 g/L NaOH溶液的物质的量浓度为________.若要计算该溶液的质量分数,还需要的一个条件是________(用文字说明).
(2)发生器中鼓入空气的作用可能是________(选填序号).
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为________吸收塔的温度不能超过20℃,其目的是________.
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是________
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中.除H2O2外,还可以选择的还原剂是________(选填序号).
a.Na2O2
b.Na2S
c.FeCl2
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________(选填序号).
a.蒸馏
b.蒸发
c.灼烧
d.过滤
e.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是________(填操作名称).
查看答案和解析>>
科目: 来源:四川省绵阳中学2011届高三化学考前热点训练:14工艺流程、无机综合题 题型:022
医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的试验操作是________.
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:
①将溶液中的少量Ca(OH)2转化为CaCl2;
②防止Ca2+在蒸发时水解;
③________.
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL.
①上述测定过程中需要溶液润洗的仪器有________.
②计算上述样品中CaCl2·2H2O的质量分数为________.
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;________.
查看答案和解析>>
科目: 来源:山东省济南外国语学校2010-2011学年高二下学期入学检测化学试题 题型:022
下图为相互串联的甲、乙两电解池.

试回答:
(1)若甲电解池利用电解原理在铁上镀银,则A是________、填电极材料),电极反应式________;B(要求同A)是________,电极反应式________,应选用的电解质溶液是________.
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈________色.C极附近呈________色.
(3)若甲电解池阴极增重4.32 g,则乙槽中阳极上放出的气体在标准状况下的体积是________mL.
(4)若乙电解池中剩余溶液仍为400 mL,则电解后所得溶液中新生成溶质的物质的量浓度为________mol·L-1,溶液的pH等于________.
查看答案和解析>>
科目: 来源:浙江省临海市杜桥中学2011届高三年级上学期九月底月考试题化学试题 题型:022
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品
,属于高毒性金属,试回答下列相关问题.(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573 K,使锌蒸馏出来.
主要反应为:2ZnS+3O2![]() 2ZnO+2SO2;鼓风炉中:2C+O2
2ZnO+2SO2;鼓风炉中:2C+O2![]() 2CO
2CO
鼓风炉中:ZnO+CO![]() Zn+CO2
Zn+CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下.实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2

①当酸度为196时,其物质的量浓度为________.
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:________、________.
(2)湿法炼锌的主要工艺流程为

①硫酸浸取的主要反应的离子方程式为:________.
②从保护环境和充分利用原料角度,如何处理或利用烟气________.
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式________.
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知CdO为碱性氧化物,Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式________、________.
查看答案和解析>>
科目: 来源:河北省魏县第一中学2011届高三上学期第一次月考化学试题 题型:022
X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.回答下列问题:
(1)L的元素符号为________;________M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示).
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________.
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,原子结构示意图为:________其最高价氧化物对应的水化物化学式为________.该族2~5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号).
a.+99.7 mol·L-1
b.+29.7 mol·L-1
c.-20.6 mol·L-1
d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:________;
由R生成Q的化学方程式:________;
查看答案和解析>>
科目: 来源:福建省三明市泰宁一中2011届高三第一次月考化学试题 题型:022
已知某溶液中只存在OH一、H+、NH4+、Cl一四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①(Cl一)>c(NH4+)>c(H+)>c(OH-)
②c(Cl一)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl一)>c(OH-)>c(H+)
④c(Cl一)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)由若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为________;
若上述关系中④是正确的,则溶液中的溶质为________.
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“
>”、“<”或“=”下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)________c(OH-).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com