
科目: 来源:物理教研室 题型:058
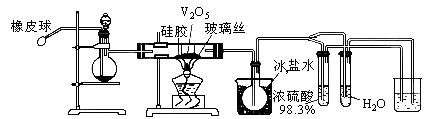
根据图回答:蒸馏烧瓶中放有________;分液漏斗中装________;硅胶的作用是________;圆底烧瓶中固体物质是________;装有H2O的试管内产生的现象和原因是________;最后一烧杯中应放的物质和作用是________。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
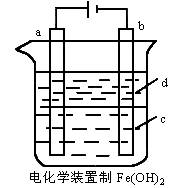
(1)a电极材料应为________,电极反应式为________。
(2)电解液c可以是(填编号)________。
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为________,在加入苯之前,对c应作何简单处理?________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)________。
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减少两电极间距离 D.适当降低电解液的温度
查看答案和解析>>
科目: 来源:物理教研室 题型:058
(1)从下列仪器中选出所需仪器(用标号字母填写)_________。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒
C.坩埚 H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是_________。
(2)某学生实验后得到以下数据:
加热前质量 加热后质量
W1(容器) W2(容器+晶体) W3(容器+无水硫酸铜)
5.4g 7.9g 6.8g
请写出结晶水含量WH2o的计算公式(用W1,W2,W3表示)________;该学生测定结果是偏高还是偏低?________,从下列分析中选出该学生实验误差的原因可能是(填写字母)________。
A.加热前称量时容器未完全干燥
B.最后两次加热后的质量相差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却
D.加热过程中有少量晶体溅失
查看答案和解析>>
科目: 来源:物理教研室 题型:058

(1)该实验应选择图中的a还是b装置?
___________________________________________________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
__________________________
A.50 mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是_____________。
A.A进B出 B.B进A出 C.从A进或B进均可
(4)由NaBr浓H2SO4和乙醇共热制备C2H5Br反应的化学方程式为_________________
________________。可能发生的副反应为:_____________________________________。
(5)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有_____________________________________________________________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是__________________,必须使用的仪器是_______________________________。
(7)本实验的产率为60%,则可制取溴乙烷______________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是_____________________________
__________________________________________________。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
加热前质量 加热后质量
m1(容器) m2(容器+晶体) m3(容器+无水CuSO4
5.4g 7.9g 6.8g
(1)请写出结晶水含量(质量分数w)的计算公式(用m1、m2、m3表示)w(H2O)=________。
(2)该生测定结晶水的含量是偏低还是偏高________。
(3)从下列分析中选出该生实验误差的原因可能是________。
A.加热前称量时,容器未完全干燥
B.最后两次加热后的质量差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失
查看答案和解析>>
科目: 来源:物理教研室 题型:058
(1)加热前应将晶体放在________中研碎,加热是放在________中进行的,加热失水后,应放在中冷却。
(2)判断是否完全失去结晶水的方法是________。
(3)做此实验,最少应进行称量操作________次。
(4)下面是某学生的一次实验数据,完成计算,填入表的空格中。
坩埚质量 11.7g
坩埚与晶体总质量 22.7g
加热后坩埚与固体总质量 18.6g
测得晶体中结晶水个数
误差(偏高或偏低)
(5)这次实验中产生误差的原因可能是下列各点中的________所造成的(填A、B、C、D)。
A.硫酸铜晶体中含不挥发性杂质
B.加热过程中有晶体溅失
C.实验前晶体表面潮湿存水
D.最后两次称量质量相差较大
查看答案和解析>>
科目: 来源:物理教研室 题型:058

已知反应物的用量:NaBr(s)0.3mol,乙醇0.25mol,浓硫酸36mL(98%,密度1.84gcm-3),水25mL,其中乙醇的密度约为水的密度的4/5。试回答:
(1)仅用图示仪器来安装制取和收集溴乙烷的装置,要求达到安全、损失少、不污染环境的目的。有关仪器的选择和连接顺序为(填数字).________。
(2)写出不能选用的仪器(填仪器代码,如甲、乙……)及其理由。
不能选用的仪器 理由
(3)反应时,若温度过高,可见有棕色气体产生。写出此反应的化学方程式:________。
(4)从棕黄色的粗溴乙烷制取无色的溴乙烷,应加入的试剂是________,必须使用的仪器是________。
(5)本实验的产率为60%,则可制取溴乙烷________g。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
其中可能发生的副反应有:2HBr+H2SO4(浓)=====Br2+SO2↑+2H2O,已知CH3CH2Br的沸点为38.4℃,密度比水大,为常温下不溶于水的油状液体。
请回答下列问题:
(1)反应中加入适量的水,除为了溶解NaBr外,作用还有:①________;②________。
(2)为了保证容器均匀受热和控制恒温,加热方法最好采用________。
(3)烧瓶中的导气管在瓶塞上的垂直部分比其他同种装置中的导管要长些的原因是________。
(4)本实验是否需要采用边反应边蒸馏的操作设计?
(5)溴乙烷可用水下收集法获得的依据和从水中分离的方法是________。
(6)下列装置在实验中既能吸收气体,又能防止液体倒吸的是________(填标号)。

查看答案和解析>>
科目: 来源:物理教研室 题型:058

(1)新法合成氨的电解池中能否用水溶液作电解质?为什么?
(2)新法合成氨中所用的电解质(图中涂色处)能传导H+,试写出电极反应和总反应式。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式________。
(2)甲同学设计的实验________(填”能”或”不能”)验证乙炔与溴发生加成反应,
其理由是________(多选扣分)。
( )
A. 使溴水褪色的反应,未必是加成反应 b. 使溴水褪色的反应,就是加成反应 c. 使溴水褪色的物质,未必是乙炔 d. 使溴水褪色的物质,就是乙炔 (3)乙同学推测此乙炔中必定含有一种杂质气体是________,它与溴水反应的化学方程式是________,在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号 填入方框,并写出装置内所放的化学药品。

(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应溶液的 酸性,理由是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com