
科目: 来源:海淀区二模 题型:填空题
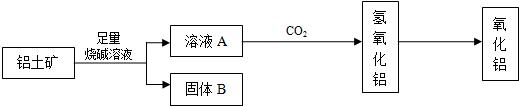
查看答案和解析>>
科目: 来源:不详 题型:填空题
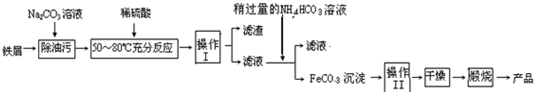

查看答案和解析>>
科目: 来源:广东模拟 题型:问答题
| ||
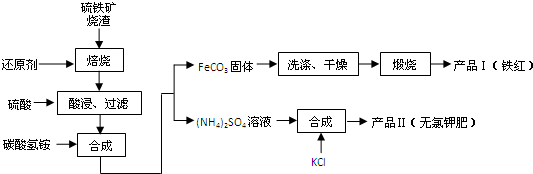
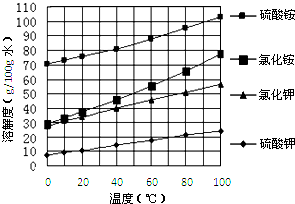
查看答案和解析>>
科目: 来源:武昌区模拟 题型:填空题



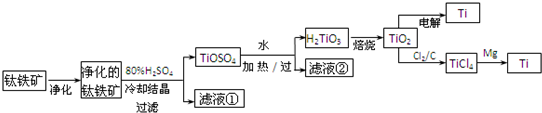
查看答案和解析>>
科目: 来源:不详 题型:问答题
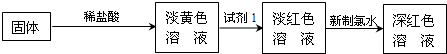
查看答案和解析>>
科目: 来源:不详 题型:问答题
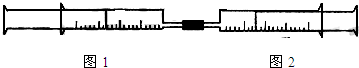
| 实验序号 | 图1针筒内物质 | 图2针筒内物质 | 图1针筒的现象 |
| 1 | 10mLFeSO4溶液 | 10mLNH3 | 生成白色沉淀,后变色 |
| 2 | 10mL1mol/LAlCl3溶液 | 40mL1mol/LNaOH溶液 | ______ |
| 3 | 10mL紫色石蕊试液 | 25mLCl2 | ______ |
| 4 | 15mLCl2 | 40mLNH3 | ______ |
查看答案和解析>>
科目: 来源:不详 题型:问答题
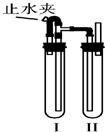
查看答案和解析>>
科目: 来源:江门一模 题型:问答题
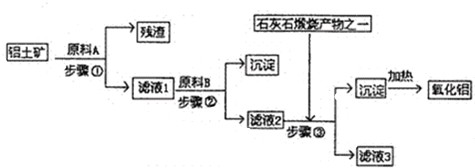
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.煤炭粉尘 | B.P2O5粉末 | C.SiO2粉尘 | D.Fe2O3粉尘 |
查看答案和解析>>
科目: 来源:聊城模拟 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com