
科目: 来源:浙江模拟 题型:单选题
| A.1.8 mol/L | B.2 mol/L | C.2.2 mol/L | D.无法计算 |
查看答案和解析>>
科目: 来源:长宁区一模 题型:单选题
| A.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 | ||
| B.将SO2通入溴水,溴水褪色后加热恢复原色,说明SO2漂白生成的物质不稳定. | ||
| C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | ||
D.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH
|
查看答案和解析>>
科目: 来源:潮州二模 题型:填空题
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3 滴______溶液 |
______ | 说法A不正确 |
| 序号 | 实验步骤 | 现象 | 结论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | 苹果中含有酚类物质 |
| ② | 一块放置于空气中 另一块迅速浸入0.1mol?L-1NaCl溶液中 |
表面逐渐褐变 相当长一段时间内,无明显变化 |
苹果褐变与______有关 |
| ③ | 另两块分别立刻放入90℃~95℃的开水和0.1mol?L-1盐酸中浸泡2min后取出,放置于空气中 | 相当长一段时间内,均无明显变化 | 苹果褐变与______有关 |
| ④ | 最后两块分别立刻放入各0.1mol?L-1的NaHCO3溶液和Na2SO3溶液里浸泡2min后取出,放置于空气 | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化 | 亚硫酸钠溶液能阻止苹果褐变 |
查看答案和解析>>
科目: 来源:朝阳区一模 题型:问答题
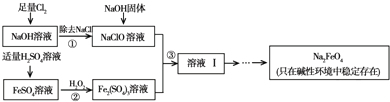
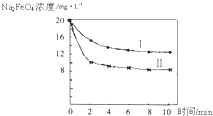
查看答案和解析>>
科目: 来源:不详 题型:问答题
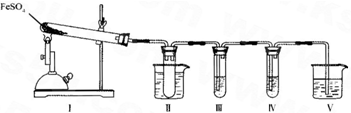
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
查看答案和解析>>
科目: 来源:江西模拟 题型:单选题
| A.向硫酸酸化的Fe2(SO4)3溶液中加入过量的Ba(OH)2溶液 |
| B.向AlCl3溶液中加入过量的氨水 |
| C.向NaOH溶液中通人CO2气体 |
| D.将过量的Cu粉加入FeCl3溶液 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 编号 | 实验 | 操作 |
| A | 证明SO2有漂白性 | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 |
| B | 配制1000mL一定物质的量浓度的硫酸溶液 | 准确称取一定体积浓硫酸,放入到1000mL的容量瓶中,加水稀释,振荡摇匀定容 |
| C | 除去FeCl3溶液中混有的FeCl2 | 向溶液中通入过量氯水,然后加热煮沸就得到了纯净的FeCl3溶液 |
| D | 检验Br-的存在 | 在溶液中先加入氯水、在加入CCl4.振荡、静置,观察下层溶液显橙红色 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目: 来源:琼海一模 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com