
科目: 来源:湖南省浏阳一中2010-2011学年高二12月月考化学试题 题型:022
将化学知识系统化,有助于对化学问题的进一步认识和理解.
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞.
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关.在热力学标准态(298 K、1.01×105 Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH).
根据以上资料回答下列问题:
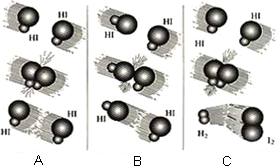
(1)下图是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________(选填“A”、“B”或“C”);
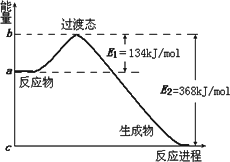
(2)下图是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________;
(3)下表是部分化学键的键能数据:
![]()
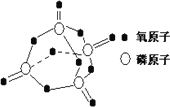
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构(P4O10)如图所示,则上表中X=________.
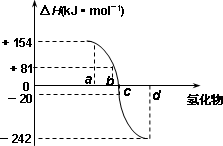
(4)下图为氧族元素的氢化物a、b、c、d的生成热数据示意图.请你归纳:非金属元素的氢化物的稳定性与氢化物的生成热(ΔH)之间的关系:________.
查看答案和解析>>
科目: 来源:湖南省浏阳一中2010-2011学年高二12月月考化学试题 题型:022
可逆反应:aA(g)+bB(g)![]() cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2 min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表示这段时间内反应的平均速率应为________.
cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2 min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表示这段时间内反应的平均速率应为________.
查看答案和解析>>
科目: 来源:湖南省浏阳一中2010-2011学年高二12月月考化学试题 题型:022
1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能.
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是________.
A.Na+(g)+Cl-(g)→NaCl(s);ΔQ
B.Na(s)+![]() Cl2(g)→NaCl(s);ΔQ1
Cl2(g)→NaCl(s);ΔQ1
C.Na(s)→Na(g);ΔQ2
D.Na(g)-e-→Na+(g);ΔQ3
E.![]() Cl2(g)→Cl(g);ΔQ4
Cl2(g)→Cl(g);ΔQ4
F.Cl(g)+e-→Cl-(g);ΔQ5
②写出ΔQ1与ΔQ、ΔQ2、ΔQ3、ΔQ4、ΔQ5之间的关系式________.
查看答案和解析>>
科目: 来源:湖南省浏阳一中2010-2011学年高二12月月考化学试题 题型:022
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65 kJ的热量.
(1)写出肼和过氧化氢的电子式:肼________,过氧化氢________.
(2)写出该反应热化学方程式:________.
(3)已知H2O(1)![]() H2O(g) ΔH=+44 kJ/mol,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ.
H2O(g) ΔH=+44 kJ/mol,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ.
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:________.
查看答案和解析>>
科目: 来源:湖南省浏阳一中2010-2011学年高二12月月考化学试题 题型:022
化学不仅为人类生活创造了丰厚的物质基础,而且为人类社会可持续发展做出了巨大贡献.
(1)蛋白质是生命的基础,是日常膳食的重要组成部分.下列食物:
①黄瓜
②大豆
③淀粉
④鸡蛋
⑤葡萄干,其中富含蛋白质的是________.(填序号).
(2)钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人,造成钢铁锈蚀的主要原因是发生电化学腐蚀.在电化学腐蚀中,水膜酸性较弱或呈中性时,发生吸氧腐蚀,其电极反应为:正极:O2+2H2O+4e-=4OH-;负极:________.水膜酸性较强时,发生析氢腐蚀,其电极反应为:正极:________.
(3)生活中的水泥、普通玻璃和陶瓷都属于________(填“金属材料”或“无机非金属材料”和“高分子合成材料”),其生产原料不需要使用石灰石的是________.材料常常成为一个时代的标志,如陶器时代、青铜器时代、铁器时代.在信息时代,你认为信息技术的关键材料的的化学式是________.
(4)碳酸氢钠是常见的疏松剂和抗酸药,请写出作抗酸药时的离子方程式________.
查看答案和解析>>
科目: 来源:湖南省嘉禾一中2011届高三1月高考押题卷化学试题 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:湖南省嘉禾一中2011届高三1月高考押题卷化学试题 题型:022
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种.
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式________;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)

③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水.该样品的结晶水质量为________g,化学式为________;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由.________;
查看答案和解析>>
科目: 来源:湖南省嘉禾一中2011届高三1月高考押题卷化学试题 题型:022
某无色溶液,其中可能存在如下离子:Na+.Ag+.Ba2+.Al3+.AlO2-.S2-.CO32-.SO32-.SO42-,现取该溶液进行有关实验,结果与下图所示.
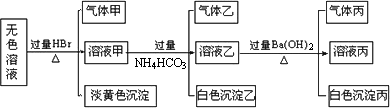
试回答下列问题:
(1)生成沉淀甲的离子方程式为________.
(2)由溶液甲生成沉淀乙的离子方程式________.
(3)沉淀丙是________.如何用一化学实验来确定其成分________.
(4)气体甲的成分有哪几种可能________.
(5)综合上述信息,可以肯定存在的离子有________,一定不存在的离子是________,可能存在的离子是________.
查看答案和解析>>
科目: 来源:湖南省嘉禾一中2011届高三1月高考押题卷化学试题 题型:022
阅读分析材料,据此完成下列要求:
短周期元素A.B.C.D.E.F,它们的原子序数依次增大,其中B和C为同一周期;D.E.F为同一周期;A和D.C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处.
(1)A元素与碳元素按质量比1∶3可以形成化合物X,将C2.X和23.4 g D2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为________.根据其反应方程式分析,若反应中有4 mol电子转移,则消耗C2的物质的量为________mol.
(2)工业上生产单质E的化学方程式为:________;指出E的氧化物在通讯中的一种用途________.
(3)一定条件下,A2气体与B2气体充分反应可生成6.8 g空间构型三角锥形的气体,放出18.44 kJ热量,则该反应的热化学方程式为为:________;A与B按原子个数比1∶2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式________.
(4)A2与C2在KOH的浓溶液中可以形成原电池.如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为:________.
(5)在10 L的密闭容器中,通入2 mol FC2和3 mol C2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21 mol/L,则平衡时FC2的转化率为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com