
科目: 来源:月考题 题型:填空题
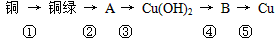
查看答案和解析>>
科目: 来源:同步题 题型:实验题

查看答案和解析>>
科目: 来源:0110 期中题 题型:填空题

查看答案和解析>>
科目: 来源:北京期末题 题型:填空题
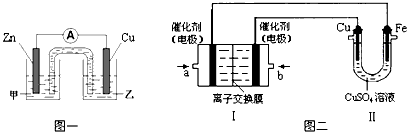
查看答案和解析>>
科目: 来源:0118 月考题 题型:填空题
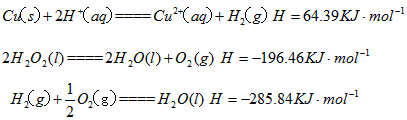

当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 ____________________________________________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备的离子方程式是____________________。
查看答案和解析>>
科目: 来源:同步题 题型:单选题
查看答案和解析>>
科目: 来源:0115 期末题 题型:单选题
查看答案和解析>>
科目: 来源:同步题 题型:填空题
查看答案和解析>>
科目: 来源:江苏高考真题 题型:填空题

查看答案和解析>>
科目: 来源:同步题 题型:填空题
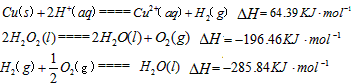
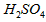 溶液中
溶液中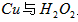 反应生成
反应生成 的热化学方程式为________________________。
的热化学方程式为________________________。  和3.0
和3.0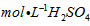 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。 
 的溶液中加入一定量的
的溶液中加入一定量的 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备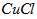
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com