
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8;E与B的质量比为1∶1.试回答:
(1)写出D原子的电子排布式________.
(2)用电子式表示AE2的形成过程________.
(3)B、C两元素的第一电离能大小关系为:________>________(填写元素符号),原因是________.
查看答案和解析>>
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
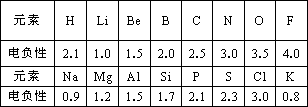
请仔细分析,回答下列有关问题:
(1)预测周期表中电负性最大的元素应为________;估计钙元素的电负性的取值范围:________<X<________.
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是________;简述元素电负性X的大小与元素金属性、非金属性之间的关系________.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为________,其理由是________.
查看答案和解析>>
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物.回答下列问题:
①若X、Y均为非金属元素,写出你所知道的XY2的化学式________、________、________、________等.
②若X原子的外围电子层排布为3d104s2,Y可能是________元素或________元素(写元素符号).
③若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:________、________、________、________、________、________、________.
查看答案和解析>>
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:

(1)写出下列元素基态原子的核外电子排布式:Sc________ Ti________ V________ Mn________
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理.人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是:________.
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是________;出现这一现象的原因是________.
查看答案和解析>>
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
水的电离平衡如下图所示.

(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为________.
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为________.
(3)已知AnBm的离子积=c(Am+)n·c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74 g,其饱和溶液的密度为1 g/mL,其离子积为________.
查看答案和解析>>
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
依据下图完成下列填空:

(1)电源正极相连的电极上所发生反应的化学方程式为________;与电源负极相连的电极附近,溶液的pH________(选填“不变”“升高”“降低”).
(2)工业食盐含Ca2+、Mg2+、Fe3+等杂质,精制过程中发生反应的离子方程式为________.
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________(选填a、b、c).a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________(选填a、b、c).
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH;后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________(填写操作名称)除去NaCl.
(6)由图示可知用离子交换膜法电解制碱工艺中的________,产品可循环使用.
查看答案和解析>>
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:
①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.
请回答:
(1)Z2Y的化学式是________,
(2)Z2Y2与X2Y反应的化学方程式是________.
(3)如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成.一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.此时:C(Ⅰ)的电极名称是________(填写正极或负极);电极反应式是:________;C(Ⅱ)的电极反应式是________.

(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是:________.
查看答案和解析>>
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6 g.请回答下列问题:

(1)B电极发生反应的电极反应式________.
(2)写出电解时反应的离子方程式________.
(3)电解后溶液的pH为________;要使电解后溶液恢复到电解前的状态,则需加入________,其质量为________.(假设电解前后溶液的体积不变)
查看答案和解析>>
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
求25℃时以下溶液的pH∶pH=3的盐酸与pH=5的硫酸等体积混合后,pH=________;pH=9的NaOH溶液稀释到原来的10倍后,pH=________,再稀释到原来的1000倍后,pH________;pH=12的NaOH和pH=4的H2SO4等体积混合后,pH=________;pH=12的NaOH和pH=1的HCl等体积混合后,pH=________;pH=12的NaOH和pH=2的HCl等体积混合后,pH=________.
查看答案和解析>>
科目: 来源:101网校同步练习 高二化学 人教社(新课标B 2004年初审通过) 人教实验版 题型:022
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com