
科目: 来源:2007-2008学年度北京四中第一学期高二年级期中测验、化学学科 题型:022
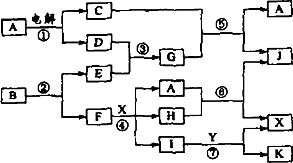
下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一,C、D、E、F都是单质.
请按要求填空:
(1)写出下列物质的化学式:A:________,E:________F:________,Y:________.
(2)反应③的化学方程式为:________.
(3)1 mol B通过反应②得到1 mol F,B中F的质量分数为72%,则B的化学式为:________.
查看答案和解析>>
科目: 来源:2007-2008学年度北京四中第一学期高二年级期中测验、化学学科 题型:022
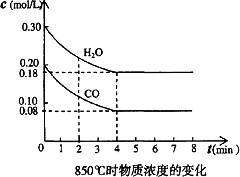
在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(气)+H2O(气)![]() CO2(气)+H2(气)(正反应是放热反应)
CO2(气)+H2(气)(正反应是放热反应)
(1)改变条件,能使正反应速率增大的是________(填序号)
A.降温
B.加压
C.增大CO2的浓度
D.使用催化剂
(2)CO和H2O浓度变化如下图,则0-4 min的平均反应速率v(CO)=________mol/(L·min)
(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
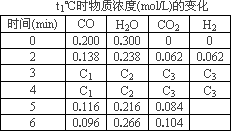
①表中3 min-4 min之间反应处于________状态;C1数值________0.08 mol/L(填大于、小于或等于).
②反应在4 min-5 min间,平衡向逆方向移动,可能的原因是________,表中5 min-6 min之间数值发生变化,可能的原因是________.
a.增加水蒸气
b.降低温度
c.使用催化剂
d.增加氢气浓度
查看答案和解析>>
科目: 来源:2007-2008学年度北京四中第一学期高二年级期中测验、化学学科 题型:022
关于下列两个反应:
①0.1 mol/L醋酸溶液:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
②0.1 mol/L醋酸钠溶液:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
(1)两式到达平衡后,加入一定量的水后,平衡向右移动的是________,溶液的pH增大的是________(此问填序号).
(2)向②反应中加入少量的醋酸钠固体,溶液的pH将________(填增大、减小、不变),若加入少量的CH3COOH,使溶液中c(Na+)=c(CH3COO-)则溶液的pH为________(填数值).
(3)若向①反应中加入少量的冰醋酸,溶液的pH将________,电离程度将________(填增大、减小、不变)
查看答案和解析>>
科目: 来源:2009年清江中学高二第二学期第一次月考化学试卷人教版 人教版 题型:022
下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
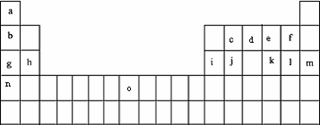
试回答下列问题
(1)元素“O”在周期表中的位置是________.
(2)画出“c”的简化电子排布式________.
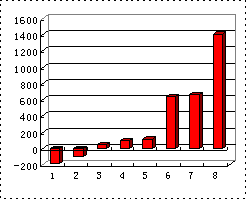
(3)第三周期8种元素按单质熔点大小顺序的柱形图如下右图(其中Si的熔点最高),其中序列“1”代表________(填字母,下同),“7”代表________.
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如下图,序列“5”氢化物的化学式为:________;序列“1”氢化物的电子式为:________.

查看答案和解析>>
科目: 来源:2009年清江中学高二第二学期第一次月考化学试卷人教版 人教版 题型:022
下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
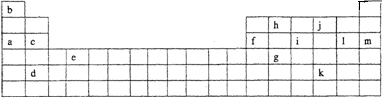
(1)下列________(填写编号)组元素的单质具有良好导电性.
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)下表是一些气态原子失去核外不同电子所需的能量,(即电离能单位为kJ·mol-1):
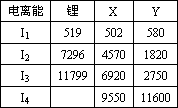
①为什么锂原子的第二电离能远远大于第一电离能________.
②表中X可能为以上13种元素中的________(填写字母)元素.用元素符号表示X和j形成化合物的化学式________.
③Y是周期表中________族元素.
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多.
查看答案和解析>>
科目: 来源:2009年清江中学高二第二学期第一次月考化学试卷人教版 人教版 题型:022
W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y.W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1,Y原子最外层s电子与p电子数之比为1∶1,Z原子核外电子中p电子数比Y原子多2个.
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:________
(2)W、X元素的最高价氧化物对应水化物的碱性最强的是________(用化学式表示).
(3)用电子式表示化合物YZ2________.
(4)四种元素的电负性由小到大的顺序为________.
(5)利用其中元素形成的化合物可以获得Z单质的反应式为________.
查看答案和解析>>
科目: 来源:2009年清江中学高二第二学期第一次月考化学试卷人教版 人教版 题型:022
现有部分短周期元素的性质或原子结构如下表:

(1)元素T的原子最外层共有________种不同运动状态的电子.元素X的一种同位素可测定文物年代,这种同位素的符号是________
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式________,该粒子的空间构型为________.
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是________.
查看答案和解析>>
科目: 来源:重庆市万州二中2008-2009学年上学期高一期中考试(化学) 题型:022
X、Y、Z、M、N分别是常见的酸、碱、盐中的某种物质,已知X是含钠元素的化合物它们之间有以下反应关系:
①2X+Y=Z+2H2O ②Z+M=BaSO4↓+2X ③M+CuSO4=BaSO4↓+N
根据上述反应
(1)推断各物质的化学式为:X________ Y_______ Z________ M________ N________
(2)完成上述反应的离子方程式:①________ ②________ ③________
查看答案和解析>>
科目: 来源:浙江省嘉兴一中2008-2009学年上学期高二期中考试(化学) 题型:022
菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸(![]() )发生酯化反应的产物.
)发生酯化反应的产物.
(1)甲一定含有的官能团的名称是________.
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是________.
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应、能与新制Cu(OH)2煮沸产生砖红色沉淀,且苯环上的一硝基取代物的结构有2种的结构简式是________.
(4)已知:
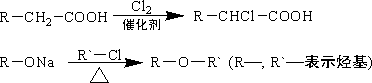
菠萝酯的合成路线如下:
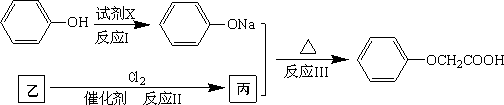
![]()
①试剂X不可选用的是(选填字母)________.
A.CH3COONa溶液 B.NaOH溶液 C.Na2CO3溶液 D.Na
②丙的结构简式是________,反应Ⅱ的反应类型是________.
③反应Ⅳ的化学方程式是______________.
查看答案和解析>>
科目: 来源:浙江省杭州高级中学2008-2009学年度高二第一学期期中考试 化学试卷 题型:022
根据图示回答下列问题:

(1)写出B、E、G的结构简式:B________,E________,G________;
(2)反应②的化学方程式是_______________,
反应④化学方程式是___________________;
(3)写出①、⑤的反应类型:①________、⑤________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com