
科目: 来源:福建省三明一中2008-2009学年高一下学期第一次月考化学试题 题型:022
有X、Y、Z、W四种短周期元素,它们的原子序数依次增大,且核电荷数总和为38.Y元素原子的最外层电子数占其核外电子总数的3/4;W元素原子最外层电子比同周期的Z元素多5个;W和Y不属于同一主族.
(1)请写出元素符号:X_________;Y_________;Z_________;W_________
(2)Z、W两元素的最高价氧化物对应的水化物反应的方程式是_________
(3)把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是_________,反应的化学方程式是_________.
查看答案和解析>>
科目: 来源:福建省泉州七中2008-2009学年高二下学期第二次月考化学试题 题型:022
下表为长式周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)表中属于d区的元素是________(填编号).
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为________;③和⑦形成的常见化合物的晶体类型是________.
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子对数为________;
(4)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同.

在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为________个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________.
查看答案和解析>>
科目: 来源:福建省泉州七中2008-2009学年高二下学期第二次月考化学试题 题型:022
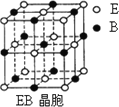
A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:

(1)写出F的基态原子核外电子排布式:________.
(2)由A、B、D三种元素形成的一种物质俗称光气,光气分子的结构式是![]() ,其中碳氧原子之间共价键是________(填序号):
,其中碳氧原子之间共价键是________(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)EB晶胞如图所示,EB晶体中E2+的配位数为________,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:EB-3401 kJ/mol、NaCl-786 kJ/mol.导致两者晶格能差异的主要原因是_______________________.
查看答案和解析>>
科目: 来源:福建省泉州七中2008-2009学年高二下学期第二次月考化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省泉州七中2008-2009学年高二下学期第二次月考化学试题 题型:022
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC________Si;SiCl4________SiO2
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.

(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热ΔH=________kJ/mol
查看答案和解析>>
科目: 来源:福建省泉州七中2008-2009学年高二下学期第二次月考化学试题 题型:022
短周期元素A、B、C、D.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P轨道中有3个未成对电子.
(1)C原子的电子排布式为________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”).
(2)当n=3时,B与C形成的晶体属于________晶体.
(3)当n=2时,B原子的核外电子中有________个未成对电子,它位于元素周期表的第________周期________族,BC2的结构式为________.
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是________(用元素符号表示).
查看答案和解析>>
科目: 来源:福建省晋江市养正中学2008-2009学年高一下学期第一次月考化学试题 题型:022
A、B、C为短周期元素,在周期表中所处位置如下图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
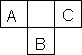
(1)写出A、B、C三种元素的名称________、________、________.
(2)B位于元素周期表第________周期,第________族.
(3)C的原子结构示意图为________.
(4)比较B、C的的原子半径,B________C,写出A的气态氢化物与B的最高价氧化物的水化物反应的化学方程式________
(5)A的单质的电子式为________,其中的化学键属于________键(填“离子”或“共价”).
查看答案和解析>>
科目: 来源:福建省古田一中2008-2009学年高二下学期第二次月考化学试卷 题型:022
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成多种气态化合物,则
(1)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是________
(2)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是________和________
(3)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是________,该盐溶液呈________性(填酸性或碱性)
查看答案和解析>>
科目: 来源:福建省古田一中2008-2009学年高二下学期第二次月考化学试卷 题型:022
短周期主族元素A、B、C、D、E的原子序数依次增大,其中B、D同主族,C、D、E同周期,A原子核外的L层电子数是K层的两倍,B是地壳中含量最高的元素,C是短周期元素中原子半径最大的主族元素.试回答下列问题:
(1)E原子的价电子排布式________.
(2)B、C、D三种元素形成的简单离子的半径由大到小的顺序是________.(用离子符号表示)
(3)AB2与DB2分子的空间立体结构分别是________和________,相同条件下两者在水中的溶解度较大的是________(写分子式),理由是________.
查看答案和解析>>
科目: 来源:福建省古田一中2008-2009学年高二下学期第二次月考化学试卷 题型:022
下表为元素周期表的一部分,a、b、c……为部分元素.回答下列问题:

(1)请写出j的单质与a、h形成的化合物发生反应的化学方程式________;
(2)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式________,它是由________键(根据原子轨道的重叠程度填写)形成化合物
(3)①请写出上;
②某元素的原子基述元素c原子的基态电子排布式为:________,该元素的最高正化合价为________态时有6个电子处于3d轨道上,则该元素原子的3d轨道上的未成对电子有________个.
③某元素的基态原子失去3个电子后,它的3d轨道内电子恰好半充满,其离子的电子排布式为________.
(4)氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
已知:H-H键能为436 kJ·mol-1,N≡N键能为945 kJ·mol-1,N-H键能为391 kJ·mol-1.写出合成氨反应的热化学方程式:________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com