
科目: 来源:中学教材全解 高中化学 必修1 人教新课标 人教新课标 题型:058
某课外活动小组用镁条与盐酸反应制氢气,推算标准状况下1 mol H2的体积.现有下列实验用品:电子天平,100 mL口径较小的测气管(如图),500 mL烧杯、100 mL烧杯、铁架台、单孔橡皮塞(与测气管径相配)、细铜丝、砂纸、镁条、水.
(1)还缺0.6 mol/L的盐酸480 mL,现请你用12 mol/L的浓盐酸进行配制,写出必须增补的实验仪器名称及规格________.
(2)选用上述药品和仪器(包括规格),完成下列实验步骤,直到反应结束.
①取一段镁条,擦去氧化物,称量.
②用细铜丝系住镁条,一端留有握持部分.
③________.
④________.
⑤________.
⑥________.
⑦待镁条全部反应后,放置10 min,调节测气管中水面的高度,使管内外的水面相平齐,读出氢气的体积.
(3)简答下列问题.
①为什么要放置10 min?________.
②为什么测气管内外水面要平齐?________.
③实验时,所处环境不是标准状况,除了测定所用镁条质量、放出氢气的体积外,还应测定哪些数据?________.
④某生做了三次实验,计算结果是:第一次:1 mol H2体积22.530 L;第二次:1 mol H2体积23.700 L;第三次:1 mol H2体积22.470 L;本次实验得出1 moL H2在标准状况下的体积为________.
⑤每次做实验所用的镁条质量为________.
A.0.030 g B.0.200 g C.0.080 g D.0.120 g
查看答案和解析>>
科目: 来源:中学教材全解 高中化学 必修1 人教新课标 人教新课标 题型:058
有一白色固体,经过初步分析得知,其中含有Na2CO3、Na2SO4、NaCl、CuSO4物质中的一种或几种.甲、乙两位同学为了进一步确定这份白色固体的组成成分而进行了如下实验,但实验中的有些问题还需你来作答.
(1)甲取少量白色固体放在试管内用水溶解,结果得无色、澄清的液体,因此甲说肯定有一种物质不存在.这种物质的化学式是________.
(2)甲又先后向那支试管内加入了稍过量的BaCl2溶液和稀硝酸,结果是先产生了白色沉淀,后又有一部分沉淀消失并从溶液里冒出无色气泡,因此甲又说肯定有两种物质存在.这两种物质的名称是________.
(3)乙将甲所得的混合物进行了过滤,取滤液约2 mL盛于另一支洁净的试管里,然后又向该试管内加入了稍过量的AgNO3溶液和稀硝酸,结果也产生了白色沉淀,因此乙说那份白色固体中肯定有NaCl.请你判断乙的结论(填“对”或“不对”)________,理由是________.
查看答案和解析>>
科目: 来源:昆山市2006-2007学年高二学业水平测试模拟试题 化学-苏教版 题型:058
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:新教材新学案 配合普通高中课程标淮实验教科书 化学② 必修 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:严中2007届高三复习物质的量单元测试A(旧人教)、化学 旧人教 题型:058
随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高.现有一种简单可行的测定的方法,具体步骤为:
(1)将固体NaCl细粒干燥后,准确称取mgNaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积Vcm3.请回答下列问题:
①步骤(1)中A仪器最好使用________.(填序号)
A、量筒
B、烧杯
C、容量瓶
D、试管
②步骤(2)中用酸式滴定管还是用碱式滴定管________,理由是________.
③能否用水代替苯________,理由是________.
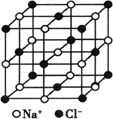
④已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为acm(如图3—4),用上述测定方法测得的阿伏加德罗常数NA的表达式为________.
查看答案和解析>>
科目: 来源:2006-2007黑龙江省实验中学高二学年第二次月考、化学试题 题型:058
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:2007届道县高考文化补习学校第三次月考试题、化学(人教) 人教 题型:058
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:安溪一中2008届高二(上)期中考试、化学试卷(理科) 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:2007新课标高一化学同步测试、第一节 物质的分类(A) 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:2007新课标高一化学同步测试、第一节 无机非金属材料的主角-硅(A) 题型:058
| |||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com