
科目: 来源:物理教研室 题型:022
在由铜片、锌片和200mL稀硫酸组成的原电池中,若锌片口只发生电化腐蚀,当在铜片上共放出2.24L气体(标准状况)时,稀 刚好用去一半,则产生这些气体消耗锌______g,共有______mol电子通过导线,原
刚好用去一半,则产生这些气体消耗锌______g,共有______mol电子通过导线,原 溶液的浓度是______mol/L.
溶液的浓度是______mol/L.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
盐酸与锌片反应时,若加入可溶性的固体醋酸铜 将产生两种影响氢气生成速率的因素.
将产生两种影响氢气生成速率的因素.
其一是__________________________________;
其二是__________________________________.
(说明影响的结果及其原因)
查看答案和解析>>
科目: 来源:物理教研室 题型:022
当可逆反应

 处于平衡状态时,向其中加入一种
处于平衡状态时,向其中加入一种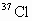 含量较多的氯气,平衡向左移动,在建立新的平衡以前,
含量较多的氯气,平衡向左移动,在建立新的平衡以前, 中所含的
中所含的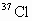 的质量分数是否比原平衡状态时增加,并说明理由.________________________________.
的质量分数是否比原平衡状态时增加,并说明理由.________________________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量.如H-H键的键能是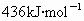 ,是指使
,是指使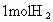 分子变回2molH原子需吸收436kJ的能量.
分子变回2molH原子需吸收436kJ的能量.
(1)已知H-C1键的键能为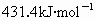 ,下列关于键能的叙述正确的是
,下列关于键能的叙述正确的是
[ ]
A.每生成1molH-C1键放出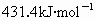 能量
能量
B.每生成1molH-Cl键吸收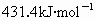 能量
能量
C.每拆开1molH-C1键放出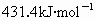 能量
能量
D.每拆开1molH-C1键吸收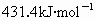 能量
能量
(2)参考下表中键能的数据,判断下列分子受热时最稳定的是
[ ]
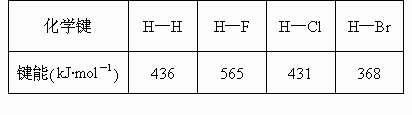
|
A.HF |
B.HCl |
C.HBr |
D. |
(3)能用键能大小解释的是
[ ]
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
查看答案和解析>>
科目: 来源:物理教研室 题型:022
298K时,合成氨的反应的热化学方程式为:

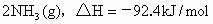 ,在该温度下,取
,在该温度下,取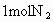 和
和 放在一密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ,其原因是__________________.
放在一密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ,其原因是__________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系,约占总质量99.97%的11种宏量元素,全部位于周期表前20号元素之内,其余0.03%是由十多种人体不可缺少的微量元素组成.现有a~g七种短周期元素,是除氧、硫、钾、钙外的其他宏量元素,它们在周期表中的位置如下,据此回答下列问题:
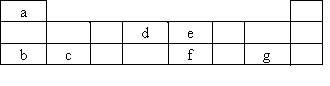
(1)下列哪一组元素的原子间反应最容易形成离子键
[ ]
哪一组元素的原子间反应容易形成共价键
[ ]
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是
[ ]
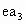
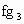
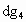
查看答案和解析>>
科目: 来源:物理教研室 题型:022
W、X、Y、Z四种元素都位于短周期内,它们的原子序数依次递增.W原子核内仅有一个质子,X原子的电子总数与Z原子的最外层电子数相等,W原子与X原子的最外层电子数之和与Y原子的最外层电子数相等.Z原子L层电子数是K.层电子数的3倍,且Z只能形成阴离子.由此推断它们的元素符号是:W______X______Y______Z______.已知W、X、Y、Z可组成一种化合物,其原子个数之比为4∶1∶2∶l,该化合物的名称是______.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
原子序数大于4的主族元素X、Y的离子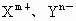 ,它们的核外电子排布相同,据此可推得:
,它们的核外电子排布相同,据此可推得:
(1)X和Y所属周期数之差为______________;
(2)X和Y的核电荷数之差为(用含m、n的代数式表示)______________.
(3)Y和X的族序数之差为(用含m、n的代数式表示)_________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
19世纪中叶,门捷列夫总结了如图所示的元素化学性质的变化状况.试回答:

(1)门捷列夫的突出贡献是
[ ]
A.提出了原子学说
B.提出分子学说
C.发现元素周期律
D.发现能量守恒定律
(2)该图表变化表明
[ ]
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是得电子能力最强的元素
C.IA族元素的失电子能力肯定比同周期ⅡA族元素的失电子能力强
D.物质发生量变到一定程度必然引起质变
(3)按照图表中元素的位置,认真观察从ⅢA族的硼到ⅦA族的砹连接的一条折线,我们能从分界线附近找到
[ ]
A.耐高温材料
B.新型农药材料
C.半导体材料
D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子 ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
[ ]
A.这种原子的中子数为167
B.它位于元素周期表中第6周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合
查看答案和解析>>
科目: 来源:物理教研室 题型:022
A、B两元素,A的原子序数为x,A和B所在周期的元素种类总数分别是m和n.
(1)如果A和B同在第IA族,当B在A的上一周期时,B的原子序数为______;当B在A的下一周期时,B的原子序数为______.
(2)如果A和B同在第ⅦA族,当B在A的上一周期时,B的原子序数为______;当B在A的下一周期时,B的原子序数为_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com