
科目: 来源: 题型:022
如图所示,甲、乙、丙是三种常见的单质,X、Y、Z是三种常见的化合物.若甲是具有还原性的单质,X、Y、Z三种化合物有一种为离子晶体:
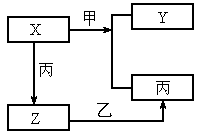
(1)X、Y、Z中含有丙元素的是_______.
(2)X与甲反应的化学方程式____________.
(3)Z的化学式________;X的电子式___________.
(4)Y的化学式_________;Y的电子式__________.
查看答案和解析>>
科目: 来源: 题型:022
在金刚石、汞、镁、氯化钾、二氧化硅、二氧化碳、晶体碘、溴化钠中,属于金属晶体的是____________,属于离子晶体的是_____________,属于分子晶体的是__________,属于原子晶体的是_______________.
查看答案和解析>>
科目: 来源: 题型:022
近年来发现许多生物体组织中存在的少量NO有扩张血管、免疫、增强记忆的功能,成为当前生命科学的研究热点.请回答问题:
(1)NO在大气层中可发生反应:
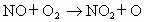 ,
,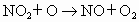
从反应过程和最终结果看,NO是________(填序号).
[ ]
(2)将NO转化为无毒气体,可选用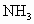 在400℃左右并有催化剂存在下把NO还原为氮气和水,该反应的化学方程式为_____________.在相同条件下能否用天然气代替
在400℃左右并有催化剂存在下把NO还原为氮气和水,该反应的化学方程式为_____________.在相同条件下能否用天然气代替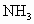 来处理硝酸尾气
来处理硝酸尾气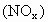 ?如有可能,请写出能发生反应的化学方程式,并指出是否具有实际意义?
?如有可能,请写出能发生反应的化学方程式,并指出是否具有实际意义?
(3)在含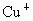 的酶的活化中心中,亚硝酸根离子可转化为NO,写出与
的酶的活化中心中,亚硝酸根离子可转化为NO,写出与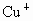 亚硝酸根离子在酸性水溶液中反应的离子方程式_________________.
亚硝酸根离子在酸性水溶液中反应的离子方程式_________________.
(4)把NO气体压缩到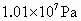 ,再加热到一定温度,发现气体的压力迅速下降,压力降至略小于原压力的2/3,然后压力就不再改变.已知其中一种产物为
,再加热到一定温度,发现气体的压力迅速下降,压力降至略小于原压力的2/3,然后压力就不再改变.已知其中一种产物为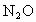 ,则上述变化的化学方程式为______________.
,则上述变化的化学方程式为______________.
所得混合气体的平均摩尔质量 的取值范围应该是_______________.
的取值范围应该是_______________.
查看答案和解析>>
科目: 来源: 题型:022
利用如图所示装置收集以下八种气种:
①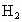 ②
②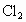 ③
③ ④
④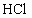 ⑤
⑤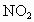 ⑥
⑥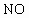 ⑦
⑦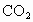 ⑧
⑧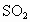
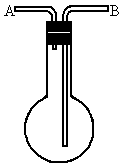
(1)若烧瓶是干燥的,则由B口进气,可收集的气体有____________.
(2)若烧瓶中充满水,可收集的气体有__________,气体由_______口进入;(3)若烧瓶中装有适量浓硫酸,可以用它来干燥的气体有______,气体应由_______口进入.
查看答案和解析>>
科目: 来源: 题型:022
A、B、C三种气体,A为无色,A能与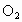 在一定条件下反应生成B,B不溶于水,它能与
在一定条件下反应生成B,B不溶于水,它能与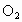 反应生成C,A、C气体均溶于水,其水溶液分别呈碱性和酸性.试推断A、B、C的化学式:
反应生成C,A、C气体均溶于水,其水溶液分别呈碱性和酸性.试推断A、B、C的化学式:
A________,B________,C_________.
查看答案和解析>>
科目: 来源: 题型:022
(1)在含 离子的酶的活化中心.亚硝酸根离子
离子的酶的活化中心.亚硝酸根离子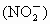 可转化为NO,写出
可转化为NO,写出 和亚硝酸根离子在酸性水溶液中反应的离子方程式:
和亚硝酸根离子在酸性水溶液中反应的离子方程式:
______________________.
(2)在常温下,把NO气体压缩到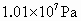 ,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为
,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为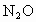 ,写出上述变化的化学方程式:________________________.
,写出上述变化的化学方程式:________________________.
(3)解释变化(2)中为什么最后的气体总压力小于原压力的____________.
查看答案和解析>>
科目: 来源:高中化学同步单元练习册第一册(高一年级) 题型:022
实验证明铜不能在低温下与反应,它不能与稀
共热发生反应,但工业上却是将废铜屑倒入热的稀
并通入空气来制备
溶液,写出该反应化学方程式________.还可用铜与浓
共热来制备
溶液,化学方程式为________.上述方法________(前、后)者好,原因是________.
查看答案和解析>>
科目: 来源: 题型:022
用定量方法进行实验,测定某铁铝合金中铝的质量分数.实验操作过程如下:称取该合金试样1.0g,放入烧杯中加足量盐酸,盖上玻璃片,使其充分反应.反应停止,经冷却向其中加入过量NaOH溶液,充分放置后过滤,对滤出的沉淀经洗涤在空气中加热灼烧至恒重,得到固体物1.2g,试回答:
(1)实验中以玻璃片盖烧杯的原因是___________________________;
(2)加入过量NaOH溶液的作用是_____________________________;
(3)加入NaOH溶液后充分放置的作用是_______________________;
(4)在空气中将沉淀灼烧的目的是_____________________________;
(5)合金中铝的质量分数为(写出计算式)________________________.
查看答案和解析>>
科目: 来源: 题型:022
铜在自然界多以+1价矿石存在.因在固态特别是高温下+1价铜化合物比+2价稳定.从辉铜矿(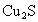 )炼钢的方法之一是:①将矿石在高温下通空气焙烧,生成两种氧化物;②将焙烧过的矿石加上比它质量约少一半的未经焙烧过的矿石,混合后隔绝空气再进行高温煅烧,结果得到铜和一种具有刺激性气味的气体.试写出这两个反应的化学方程式.
)炼钢的方法之一是:①将矿石在高温下通空气焙烧,生成两种氧化物;②将焙烧过的矿石加上比它质量约少一半的未经焙烧过的矿石,混合后隔绝空气再进行高温煅烧,结果得到铜和一种具有刺激性气味的气体.试写出这两个反应的化学方程式.
①__________________________;②_________________________
查看答案和解析>>
科目: 来源: 题型:022
某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag,称量时应该使用的主要仪器的名称是_______________.
(2)将样品溶解于足量的稀盐酸,过滤.滤液中主要含有____________,滤渣中含有____________,溶解、过滤用到的玻璃仪器是___________.
(3)滤液中加过量NaOH溶液、过滤.有关的离子方程式是_____________.
(4)步骤(3)的滤液中通入足量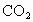 气体,可产生沉淀,过滤.有关的离子方程式是_______________________.
气体,可产生沉淀,过滤.有关的离子方程式是_______________________.
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称量,其质量为bg,原样品中铝的质量分数为______________________.
(6)若步骤(3)中加入NaOH的量不足,则实验结果偏_________(填“高”“低”“无影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com