
科目: 来源: 题型:022
 可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大.请回答下列问题:
可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大.请回答下列问题:
(1) 是平面正方形结构,还是四面体结构____________.
是平面正方形结构,还是四面体结构____________.
(2)请在以下横线上画出这两种固体分子的几何构型图:淡黄色固体____________,黄绿色固体________________.
(3)淡黄色固体物质由___________组成,黄绿色固体物质由________组成(填“极性分子”或“非极性分子”).
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是____________.
查看答案和解析>>
科目: 来源: 题型:022
已知硫酸(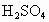 )分子的结构可表示为
)分子的结构可表示为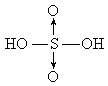 (其中“S→O”是特殊的共价键——配位键,共用的一对电子由S原子提供),而焦硫酸存在于发烟硫酸中,其分子式为
(其中“S→O”是特殊的共价键——配位键,共用的一对电子由S原子提供),而焦硫酸存在于发烟硫酸中,其分子式为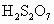 ,分子结构中不存在“—S—S—”键。请在注意了两者组成上的差别后,试写出焦硫酸分子的结构式________;在焦硫酸中,硫的化合价为________价.
,分子结构中不存在“—S—S—”键。请在注意了两者组成上的差别后,试写出焦硫酸分子的结构式________;在焦硫酸中,硫的化合价为________价.
查看答案和解析>>
科目: 来源: 题型:022
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.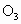 能吸收有害紫外线,保护人类赖以生存的空间.
能吸收有害紫外线,保护人类赖以生存的空间.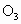 分子的结构如图所示,呈V形,键角为116.5°.三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子.请回答:
分子的结构如图所示,呈V形,键角为116.5°.三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子.请回答:
(1)臭氧与氧气的关系是________.
(2)下列分子与 分子的结构最相似的是________.
分子的结构最相似的是________.
|
A. |
B. |
C. |
D. |
(3) 分子有________对孤对电子.
分子有________对孤对电子.
(4)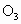 分子是否为极性分子________(填“是”或“否”).
分子是否为极性分子________(填“是”或“否”).
(5)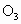 具有强氧化性,它能氧化PbS为
具有强氧化性,它能氧化PbS为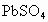 ,而
,而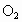 不能,试配平:
不能,试配平:
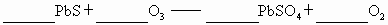
生成1mol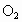 ,转移电子_______mol.
,转移电子_______mol.
查看答案和解析>>
科目: 来源: 题型:022
气态氯化铝分子以双聚形式存在,其结构式如下所示,其中Cl→Al表示Cl原子提供一对电子与Al原子共享.又已知硼酸 为白色固体,溶于水显弱酸性,但它只是一元酸.可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因,请写出下面这个方程式右端的两种离子的表达式:
为白色固体,溶于水显弱酸性,但它只是一元酸.可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因,请写出下面这个方程式右端的两种离子的表达式: .
.

查看答案和解析>>
科目: 来源: 题型:022
气体A只含X、Y两种短周期元素,X的原子序数大于Y,B、D、E是中学化学中常见的气体,各物质之间有如下所示的转化关系.
试回答:
(1)若气体A中,X与Y的质量比恒小于3/1,则气体A中肯定有(写化学式)______________;
(2)若气体A的分子为平面结构,且X与Y两元素的质量比在数值上等于X的相对原子质量的1/2,则X元素位于周期表第________周期第_______族.
(3)C与固体甲在高温下反应的化学方程式为____________.
查看答案和解析>>
科目: 来源: 题型:022
下表是元素周期表的一部分

(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素⑨的氢化物的还原性_________(填“强”或“弱”).
(2)俗称为“矾”的一类化合物通常含有共同的元素是_______.
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的化学方程式:____________,又如表中与元素⑦的性质相似的不同族元素是________(填元素符号).
查看答案和解析>>
科目: 来源: 题型:022
A、B、C、D 4种短周期元素的原子序数依次增大.A、D同族,B、C同周期.A、B组成的化合物甲为气态,其中A、B原子数之比为4∶1.由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子数之比为1∶1,丙中为2∶1.由D、C组成的两种化合物丁和戊都为固态,丁中D、C原子数之比为1∶1,戊中为2∶1.写出分子式:甲_______、乙________、丙________、丁__________戊_________;写出B元素的最高价氧化物跟丁发生反应的化学方程式:____________________________________.
查看答案和解析>>
科目: 来源: 题型:022
(2005·上海)(A)
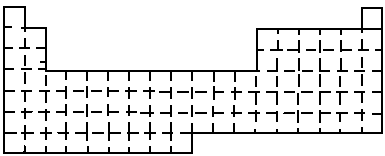
(1)在上面元素周期表中画出金属元素与非金属元素的分界线.
(2)根据NaOH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的__________族.
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应呈黄色.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲元素与硫元素相比较,非金属性较强的是________(填名称),写出可以验证该结论的一个化学反应方程式_______.
(B)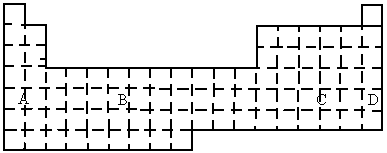
(1)在上面元素周期表中全部是金属元素的区域为_______.
|
a.A |
b.B |
c.C |
d.D |
(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是______.
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是__________(填名称),可以验证该结论的实验是___________.
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目: 来源: 题型:022
已知元素的电负性和原子半径等一样,也是元素的一种基本性质.下表给出14种元素的电负性:
![]()
试结合元素周期律知识完成下列问题:
根据上表给出的数据,可推知元素的电负性具有的变化规律是_________.
查看答案和解析>>
科目: 来源: 题型:022
根据有关知识完成下列问题:
(1)在化学元素中,第一电离能最小的是_____,最大的元素是_________.
(2)铬的原子序数是24,其外层价电子构型是________.
(3)元素的电负性越大,则在分子中此元素________越强.
(4)Be的第一电离能大于B的第一电离能,这是因为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com