
科目: 来源: 题型:022
常温下将0.010mol 和0.004 0mol HCl溶于水,配制成0.5L混合溶液.判断:
和0.004 0mol HCl溶于水,配制成0.5L混合溶液.判断:
(1)溶液中共有________种微粒.
(2)溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是________.
(3)溶液中 .
.
查看答案和解析>>
科目: 来源: 题型:022
1884年,瑞典科学家阿累尼乌斯提出电离理论.该理论认为:电解质在水溶液中可以电离.电离时产生的阳离子全部是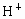 的化合物叫酸;电离时产生的阴离子全部是
的化合物叫酸;电离时产生的阴离子全部是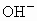 的化合物叫碱,然而电离理论也有局限性,它把酸碱仅限于水溶液中,无法说明物质在非水溶液中的酸碱性问题.近几十年来,科学实验中越来越多的使用非水溶剂(如液氨、乙醇、苯、四氯化碳、丙酮等).1923年,布朗斯特和劳莱提出酸碱质子理论.该理论认为:凡能给出质子(
的化合物叫碱,然而电离理论也有局限性,它把酸碱仅限于水溶液中,无法说明物质在非水溶液中的酸碱性问题.近几十年来,科学实验中越来越多的使用非水溶剂(如液氨、乙醇、苯、四氯化碳、丙酮等).1923年,布朗斯特和劳莱提出酸碱质子理论.该理论认为:凡能给出质子(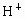 )的物质都是酸;凡能接受质子(
)的物质都是酸;凡能接受质子(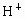 )的都是碱.酸碱质子理论扩大了酸碱的范围,更新了酸碱的含义.
)的都是碱.酸碱质子理论扩大了酸碱的范围,更新了酸碱的含义.
(1)今有下列物质:①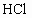 ;②
;②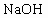 ;③
;③ ;④
;④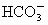 ;⑤
;⑤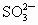 ;⑥
;⑥ ;⑦
;⑦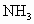 ;⑧
;⑧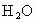 .按照酸碱质子理论,上述物质中只属于酸的有________;只属于碱的有________;属于两性化合物的有________.
.按照酸碱质子理论,上述物质中只属于酸的有________;只属于碱的有________;属于两性化合物的有________.
(2)按照酸碱质子理论,中和反应就是酸碱之间________传递的反应.判断下列反应是否为中和反应? .
.
查看答案和解析>>
科目: 来源: 题型:022
(2003·全国)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B和C均为4.0mol,D为6.5mol,F为2.0mol,设E为x mol.当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.请填写以下空白:
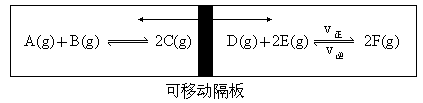
(1)若x=4.5,则右侧反应在起始时向________(填“正反应”或“逆反应”)方向进行.欲使起始反应维持向该方向进行,则x的最大取值应小于________________.
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等_________(填“相等”“不相等”或“不能确定”).其理由是:__________________________________________________.
查看答案和解析>>
科目: 来源: 题型:022
(2003·上海)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘.
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数.

(2)已知含氧酸盐的氧化作用随溶液酸性的增强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测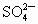 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这种变化趋势发生的原因:______________.
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这种变化趋势发生的原因:______________.
查看答案和解析>>
科目: 来源: 题型:022
(2003·上海)牙齿表面由一层硬的成分为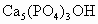 的物质保护着,它在唾液中存在下列平衡:
的物质保护着,它在唾液中存在下列平衡:
 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是______________
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是______________
_____________________________________________________________.
已知 的溶解度比上面的矿化产物更小,质地更坚固.当用牙膏中配有氟化物添加剂后能防止龋齿的原因:___________________.
的溶解度比上面的矿化产物更小,质地更坚固.当用牙膏中配有氟化物添加剂后能防止龋齿的原因:___________________.
根据以上原理,请你提出另外一种促进矿化的方法.________________.
查看答案和解析>>
科目: 来源: 题型:022
(2003·上海)将等物质的量(m)的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(s)+dD 当反应进行一定时间后,测得A减少了n mol,B减少了
cC(s)+dD 当反应进行一定时间后,测得A减少了n mol,B减少了 mol,C增加了
mol,C增加了 mol,D增加了n mol,此时达到化学平衡:
mol,D增加了n mol,此时达到化学平衡:
(1)该化学方程式中各物质的系数为a=________、b=________、c=________、d=________.
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A________、B________、D________.
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”).
查看答案和解析>>
科目: 来源: 题型:022
(2003·上海)某化学反应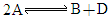 在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(
在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度( )随反应时间(min)的变化情况见下表.
)随反应时间(min)的变化情况见下表.

根据上述数据,完成下列填空:
(1)在实验1中,反应在10min至20min时间内平均速率为_________ .
.
(2)在实验2,A的初始浓度 =________
=________ ,反应经20min就达到平衡,可推测实验2中还隐含的条件是___________________________.
,反应经20min就达到平衡,可推测实验2中还隐含的条件是___________________________.
(3)设实验3的反应速率为 ,实验1的反应速率为
,实验1的反应速率为 ,则
,则 ________
________ (填“>”“=”或“<”),且
(填“>”“=”或“<”),且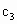 ________1.0
________1.0 (填“>”“=”或“<”).
(填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”).理由是_______________________.
查看答案和解析>>
科目: 来源: 题型:022
(2004·吉林)对于2X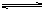 Y(g)的体系,在压强一定时,平衡体系中Y的质量分数
Y(g)的体系,在压强一定时,平衡体系中Y的质量分数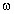 (Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
(1)该反应的正反应方向是一个________反应(填“吸热”或“放热”).
(2)A、B、C、D、E各状态中,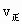 <
< 的是________.
的是________.
(3)维持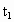 不变,E
不变,E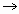 A所需时间为x,维持
A所需时间为x,维持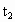 不变,D
不变,D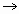 C所需时间为y,则x________y(填“<”“>”或“=”).
C所需时间为y,则x________y(填“<”“>”或“=”).
(4)欲要求使E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是________________________________.

查看答案和解析>>
科目: 来源: 题型:022
某学生做浓度对化学反应速率的影响的实验时,将3支试管编号为①②③,并按下表中物质的量进行实验,记录下的时间数据是:16s、28s、33s.请将3个数据填入下表的适当位置,并写出实验结论.
(1)将对应①、②、③的时间分别写出:
(a)________,(b)________,(c)________;
(2)实验结论________;
(3)写出反应的化学方程式________________.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com