
科目: 来源: 题型:022
X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收。已知X是化石燃料燃烧的产物之一,是形成酸雨的主要物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应。请写出下列反应的化学方程式。
(1)X在一定条件下与氧气反应。
(2)Y与氢氧化钠溶液的反应。
(3)Z与水的反应。
查看答案和解析>>
科目: 来源: 题型:022
以金红石(主要成分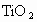 )为原料生产金属钛的步骤主要有:
)为原料生产金属钛的步骤主要有:
(1)在高温下,向金红石与焦炭的混合物中通入 ,得到
,得到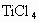 和一种可燃性气体;
和一种可燃性气体;
(2)在稀有气体(如氩)氛围和加热的条件下,用镁与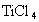 反应可得到钛。
反应可得到钛。
请写出上述两步反应的化学方程式,并分析反应(2)时稀有气体氛围的作用。
查看答案和解析>>
科目: 来源: 题型:022
工业上以铝土矿(主要成分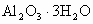 )为原料生产铝,主要包括下列过程:
)为原料生产铝,主要包括下列过程:
(1)将铝土矿中的氧化铝合物溶解在氢氧化钠溶液中;
(2)通入二氧化碳使(1)所得溶液中析出氢氧化铝固体;
(3)使氢氧化铝脱水生成氧化铝;
(4)电解熔融氧化铝生成铝。
请写出上述各有关反应的化学方程式,并推测哪一步转化过程消耗的能量最多,为什么?
查看答案和解析>>
科目: 来源: 题型:022
试写出工业上海水提溴、实验室中海带提碘过程中所发生的主要反应的离子方程式。根据上述事实,关于 、
、 、
、 、
、 、
、 五种物质的氧化性相对强弱,你可以明确得出的结论有哪些?推测下列过程的结果,写出有关反应的化学方程式。
五种物质的氧化性相对强弱,你可以明确得出的结论有哪些?推测下列过程的结果,写出有关反应的化学方程式。
(1)将氯气通入溴化钠溶液中;
(2)将溴水加入氟化钠溶液中;
(3)将氯水通入碘化钠溶液中;
(4)将碘加入溴化钠溶液中。
查看答案和解析>>
科目: 来源: 题型:022
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
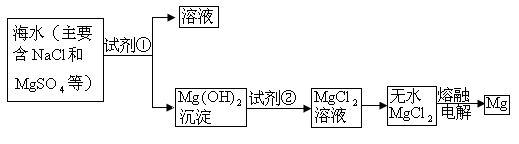
(1)为了使 转化为
转化为 ,试剂①可以选用_______,要使
,试剂①可以选用_______,要使 完全转化为沉淀,加入试剂①的量应_______;
完全转化为沉淀,加入试剂①的量应_______;
(2)加入试剂①后,能够分离得到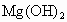 沉淀的方法是________;
沉淀的方法是________;
(3)试剂②可以选用_______;
(4)无水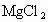 在熔融状态下,通电后会产生
在熔融状态下,通电后会产生 和
和 ,该反应的化学方程式为:__________。
,该反应的化学方程式为:__________。
查看答案和解析>>
科目: 来源: 题型:022
已知难溶于水的盐在水中存在溶解平衡,例如氯化银在水中的溶解平衡为
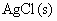


在一定温度下,水溶液中银离子( )和氯离子(
)和氯离子( )的物质的量浓度的乘积为一常数,可用
)的物质的量浓度的乘积为一常数,可用 表示:
表示: 现把氯化银(足量)分别放入:①100mL蒸馏水中;②
现把氯化银(足量)分别放入:①100mL蒸馏水中;②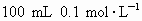 盐酸溶液中;③
盐酸溶液中;③ 的氯化铝溶液中;④
的氯化铝溶液中;④ 的氯化镁溶液中,充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(用序号回答)________.在
的氯化镁溶液中,充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(用序号回答)________.在 氯化铝溶液中,银离子的物质的量浓度最大可达到________
氯化铝溶液中,银离子的物质的量浓度最大可达到________ .
.
查看答案和解析>>
科目: 来源: 题型:022
某亚硫酸钠试剂已部分被氧化,为确定它的纯度,要进行如下实验:
①称取样品 ;②将样品溶解;③给溶液加入稍过量盐酸酸化了的
;②将样品溶解;③给溶液加入稍过量盐酸酸化了的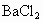 溶液;④过滤、洗涤、干燥沉淀,称其质量为
溶液;④过滤、洗涤、干燥沉淀,称其质量为 .试回答:
.试回答:
(1)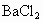 要用盐酸酸化的原因是________.
要用盐酸酸化的原因是________.
(2)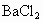 溶液要稍过量的原因是________.
溶液要稍过量的原因是________.
(3)判断操作③是否完成的方法是________.
(4)判断沉淀是否洗净的方法是________.
(5) 纯度的表示式为________.
纯度的表示式为________.
查看答案和解析>>
科目: 来源: 题型:022
水的电离平衡线如图所示.

(1)若以A点表示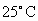 时水在电离平衡时的离子浓度,当温度上升到
时水在电离平衡时的离子浓度,当温度上升到 时,水的电离平衡状态到B点,则此时水的离子积从________增加到________.
时,水的电离平衡状态到B点,则此时水的离子积从________增加到________.
(2)将pH=8的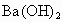 溶液与pH=5的稀盐酸混合,并保持
溶液与pH=5的稀盐酸混合,并保持 恒温,欲使混合溶液pH=7,则
恒温,欲使混合溶液pH=7,则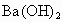 与盐酸的体积比为________.
与盐酸的体积比为________.
(3)已知 的离子积=
的离子积= ,式中
,式中 和
和 表示离子的物质的量浓度.在某温度下
表示离子的物质的量浓度.在某温度下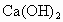 的溶解度为0.74g,其饱和溶液密度设为
的溶解度为0.74g,其饱和溶液密度设为 ,其离子积为________.
,其离子积为________.
查看答案和解析>>
科目: 来源: 题型:022
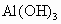 为两性氢氧化物,在水溶液中存在酸式电离和碱式电离两种形式,试根据平衡移动原理,解释下列有关问题.
为两性氢氧化物,在水溶液中存在酸式电离和碱式电离两种形式,试根据平衡移动原理,解释下列有关问题.
(1)向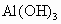 ,沉淀中加入盐酸,沉淀溶解,其原因是_____________________,有关离子方程式是_______________________.
,沉淀中加入盐酸,沉淀溶解,其原因是_____________________,有关离子方程式是_______________________.
(2)向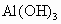 沉淀中加入苛性钠溶液,沉淀溶解,其原因是______________________,有关离子方程式是_____________________.
沉淀中加入苛性钠溶液,沉淀溶解,其原因是______________________,有关离子方程式是_____________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com