
科目: 来源:中学教材全解 高中化学 必修1 人教新课标 人教新课标 题型:022
向明矾水溶液中滴加适量氨水,现象是________,反应的离子方程式是________,再向其中加入过量NaOH溶液,反应现象是________,反应的离子方程式为________.
查看答案和解析>>
科目: 来源:中学教材全解 高中化学 必修1 人教新课标 人教新课标 题型:022
有一位同学进行萃取的操作,如图所示意的是他(她)在倒转分液漏斗振荡,促使液体充分混合,从图上来看,他(她)的实验中的错误是________,这种错误所导致的实验不良结果是________.他(她)振荡完毕之后,将分液漏斗正立于铁架台的铁圈上,轻轻打开分液漏斗的玻璃活塞,结果分液漏斗的颈下刚刚流出少量的液体以后就再也不流了.但他(她)经全面、仔细地检查以后,结论是分液漏斗本身并没有缺陷和故障.请你来分析说明液体停流的原因,并提出解决问题的方法________.
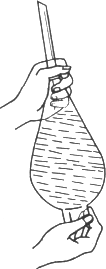
查看答案和解析>>
科目: 来源: 题型:022
周期表中位于ⅦA族的A元素的原子由28个基本粒子构成,位于ⅤA族的B元素的原子由21个基本粒子构成,它们分别与原子核中无中子的C元素的原子形成分子,用电子式表示A和C的原子形成分子的过程__________________,A、C元素组成的化合物溶于水显________性,这是因为__________________;C和B的原子形成的分子中有___________个________键,它们之间键角为________,分子构型呈________形,是________分子,C、B元素组成的化合物溶于水显________性;上述两种化合物相互反应产物的电子式为_____ ___。
查看答案和解析>>
科目: 来源: 题型:022
X、Y、Z是周期表中相邻的三种元素,其中X、Y同主族,Y、Z同周期。此三种元素原子最外层电子数之和为16,质子数总和为38。则X、Y、Z分别是________。
查看答案和解析>>
科目: 来源: 题型:022
A、B、C、D四种短周期元素的原子序数依次增大.A、D同族,B、C同周期.A、B组成的化合物甲为气态.甲中A、B原子数之比为4∶1.由A、C组成的两种化合物乙和丙都为液态.乙中A、C原子数之比为1∶1.丙中A、C原子数之比为2∶1.由D、C组成的两种化合物丁和戊都为固态.丁中D、C原子数之比为1∶1.戊中D、C原子数之比为2∶1.
写出化学式:甲________,乙________,丙________,丁________,戊________.写出B元素的最高价氧化物跟丁发生反应的化学方程式:________________________.
查看答案和解析>>
科目: 来源: 题型:022
根据原子序数1~18的元素的单质及其化合物的性质,填写下列空白(尽量用化学式):
(1)与水反应最剧烈的非金属单质是________。
(2)某元素形成的单质贮存时要保存在煤油里,该单质为________。
(3)水溶液酸性最强的氢化物的化学式为________。
(4)元素最高价氧化物对应水化物既能与强酸反应又能与强碱反应的物质的化学式为________。
(5)某元素原子的最外层与次外层电子数之差为2,其低价氧化物不能燃烧,该氧化物若排入空气则能对空气造成污染,该元素是________。
查看答案和解析>>
科目: 来源: 题型:022
A、B、C、D四种短周期元素的原子序数依次增大。A、D同族,B、C同周期。A、B组成的化合物甲为气态,其中A、B原子数之比为4∶1。由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子数之比为1∶1,丙中为2∶1。由D、C组成的两种化合物丁和戊都为固态,丁中D、C原子数之比为1∶1,戊中为2∶1。写出分子式:甲________、乙________、丙________、丁________、戊________;写出B元素的最高价氧化物跟丁发生反应的化学方程是________。
查看答案和解析>>
科目: 来源: 题型:022
在周期表中,同一主族元素化学性质相似.目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则.据此请回答:
(1)锂在空气中燃烧,除生成________外,也生成微量的________.
(2)铍的最高价氧化物的水化物的化学式是________,属两性化合物,证明这一结论的有关离子方程为___ _____.
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为___________ _____________.
(4)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
用电子式表示BeCl2的形成过程__ ______.
查看答案和解析>>
科目: 来源: 题型:022
a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数 (单位电荷) |
O |
1+ |
1- |
O |
2+ |
1+ |
O |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子.
(1)a微粒的核外电子排布结构示意图为________.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱相比较,为________>________(用化学式表示).
(3)d溶于水的电离方程式为_____ ___.
(4)g微粒所构成的晶体类型属________.
(5)c微粒是________,f微粒是________(用化学式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com