
科目: 来源: 题型:022
有A、B、C、D、E五种元素,它们的原子序数依次增大。
①D的氢化物分子式为H2D,D的最高价氧化物中含D40%,而且D原子核内的质子数和中子数相等。
②A的原子的最外层电子数是次外层电子数的2倍;B的阴离子和C的阳离子与氖原子的电子层结构相同;E原子的最外层电子数比次外层电子数少1,比倒数第三层上的电子数多5。
③常温常压下,B的单质是气体,0.1molB的单质与足量H2反应时,有0.4NA个电子转移。
④C的单质在B的单质中充分燃烧生成淡黄色固体,此固体与AB2反应又能生成B的单质,据上面叙述,回答:
(1)写出元素符号A________、B________、C________、D________、E________。
(2)C的离子结构示意图为________,C位于周期表中________周期________族。
(3)A、C、D、E最高价氧化物对应水化物的分子式为________、________、________、________。
(4)C单质在B单质中燃烧生成的淡黄色固体的电子式为________________、此固体与AB2反应的化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:022
已知A、B、C、D四种元素,A和B的离子结构都和氖原子具有相同的电子排布。C的离子结构比氖原子多8个电子,D的离子结构比氙原子少18个电子,A元素位于某一周期的开始,其离子的焰色为黄色;B元素的单质每摩尔能从酸中置换出1.5mol氢气,C元素离子的焰色为紫色;D元素的单质在常温下为液态,它的负一价离子能跟银离子反应生成不溶于硝酸的沉淀,
(1)四种元素的符号分别为:A________,B________,C________,D________。
(2)B、C两元素最高价氧化物水化物的化学式分别是________,________。
(3)在盛有B的氢氧化物的试管中,分别加入强酸和强碱时,其现象分别是________,________,离子方程式分别是________,________。
(4)A和D形成化合物的电子式是________,化合物中化学键类型为________。
查看答案和解析>>
科目: 来源: 题型:022
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所 示。试根据元素在周期 表中的位 置,分析图中曲线的变化特点,并 回答下列问题。1至19号元素气态 原子失去最外层一个电子所需能量。

(1)同主族内不同元素的E值变化 的特点是:________,各主族中E 值的这种变化特点体现了元素性质 的________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象,试预 测下列关系中正确的是________(填写编号,多选倒扣); ①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E <________。
(4)10号元素E值较大的原因是________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
三硅酸镁晶体被用来治疗胃溃疡病患者的胃酸过多症,是因为该物质不溶于水,服用后能中和胃酸,作用持久.三硅酸镁晶体的化学式为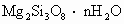
(1)用氧化物形式表示三硅酸镁的化学式.
(2)写出该药物中和胃酸的化学方程式.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
利用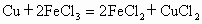 设计一个原电池.
设计一个原电池.
(1)写出原电池的电极的反应式.
负极:_____________.正极:____________.
(2)画出装置图.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
某1 mol链烃A,在一定条件下完全裂化成1 mol烷烃B和1 mol烯烃C,生成的混合气体对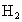 的相对密度为14.5.试通过计算回答下列问题:
的相对密度为14.5.试通过计算回答下列问题:
(1)写出链烃A可能的结构简式和名称.
(2)烷烃B和烯烃C可能各是什么?
(3)如果1 mol B完全燃烧时需要氧气的物质的量是整数,那么C只能是什么烯烃?
查看答案和解析>>
科目: 来源:物理教研室 题型:022
有A、B、C、D四种元素,A的最高正价与其最低负价的绝对值之差为6;A、D次外层都是8个电子,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴阳离子,B有2个电子层,其最高正价与最低负价的代数和为零,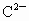 与氪原子具有相同的电子层结构.试写出上述元素的符号A______,B______,C________,D_________.
与氪原子具有相同的电子层结构.试写出上述元素的符号A______,B______,C________,D_________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
有A、B、C、D、E五种元素,C和D的原子序数分别比E和A的原子
序数大1.C和D能形成 的化合物.B和D的离子具有相同的电子层结构,B是同周期中除稀有气体外原子半径最大的元素,A元素在其最高价氧化物中含量是40%,在其氢化物中的含量是94.1%,A原于中质子、中子、电子数相等,18gC和足量的稀
的化合物.B和D的离子具有相同的电子层结构,B是同周期中除稀有气体外原子半径最大的元素,A元素在其最高价氧化物中含量是40%,在其氢化物中的含量是94.1%,A原于中质子、中子、电子数相等,18gC和足量的稀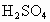 反应,在标准状况下生成22.4L
反应,在标准状况下生成22.4L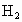 ,C原子中有14个中子,问A、B、C、D、E各是什么元素,并且分别指出它们在周期表中的位置.
,C原子中有14个中子,问A、B、C、D、E各是什么元素,并且分别指出它们在周期表中的位置.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
利用如图所示的装置收集以下7种气体:
A 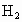 , B
, B
![]() C
C
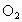 , D
HCl, E
, D
HCl, E
![]() , F
NO, G
, F
NO, G
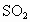
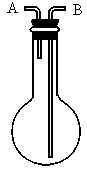
(1)若烧瓶是干燥的,则由B口进气,可收集的气体有_________,若把装置颠倒,由A口进气,可收集的气体有__________.
(2)若在烧瓶内充满水,可收集的气体有___________,气体应由_____________口进入.
(3)若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有___________,气体应由______________口进入.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com