
科目: 来源:福建省厦门六中2010-2011学年高二下学期期中考试化学试题 题型:022
X、Y、Z、L、M五种短周期元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,其中X是原子半径最小的元素,L是地壳中含量最高的元素.M是地壳中含量最高的金属元素.回答下列问题:
(1)Z的单质一个分子中含有________个π键;M的原子结构示意图为________
(2)五种元素原子半径从大到小的顺序是________(用元素符号表示)
(3)Y、Z、L三种元素第一电离能由大到小的顺序是________(用元素符号表示)
(4)Z、X两元素按原子数目比l∶3和2∶4分别构成分子A和B,A分子空间构型为________,A分子中Z原子的轨道杂化方式为________,B的结构式为________.
(5)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________.
该族2~5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号).
a.+99.7 mol·L-1
b.+29.7 mol·L-1
c.-20.6 mol·L-1
d.-241.8 kJ·mol-1
查看答案和解析>>
科目: 来源:福建省厦门六中2010-2011学年高二下学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省厦门六中2010-2011学年高二下学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省三明市四地六校2010-2011学年高二下学期期中联考协作卷化学试题 题型:022
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省三明市四地六校2010-2011学年高二下学期期中联考协作卷化学试题 题型:022
一定条件下,由N2和H2合成1 mol NH3时可放出46.2 kJ的热量.已知N≡N键的键能是948.9 kJ/mol,H-H键的键能是436.0 kJ/mol,试计算N-H键的键能是________写出氮气和氢气在该条件下合成氨的热化学方程式________
查看答案和解析>>
科目: 来源:福建省三明市四地六校2010-2011学年高二下学期期中联考协作卷化学试题 题型:022
现有下列物质,请用字母填空:
A.干冰
B.金刚石
C.氦
D.晶体硅
E.过氧化钠
F.二氧化硅
G.氯化铵
(1)属于原子晶体的化合物是________,
(2)固态时不含化学键的分子晶体是________
(3)含有非极性键的离子化合物是________.
(4)含有离子键、共价键、配位键的化合物是________.
(5)含有极性键的非极性分子构成的物质是________.
查看答案和解析>>
科目: 来源:福建师大附中2010-2011学年高二下学期期中考试化学试题 题型:022
铁及铁的化合物在生产、生活中有着重要的用途.
(1)聚合硫酸铁(简称PFS)的化学式为[Fe(OH)n(S04)(3-n)/2]m,现代潜水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.则PFS的中心原子未成对电子数为________个.
(2)六氰合亚铁酸钾K4[Fe(CN)6]可用做显影剂,该化合物中存在的化学键类型有________.
(3)CN一中碳原子的杂化轨道类型是________:写出一种与CN一互为等电子体的分子的化学式________;
(4)三氯化铁常温下为固体,熔点304℃,沸点316℃在300℃以上可升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为________晶体.
(5)普鲁士蓝是一种配合物,可用作染料,它的结构单元如下图所示,普鲁士蓝中n(K+):n(Fe3+):n(Fe2+):n(CN一)=________.
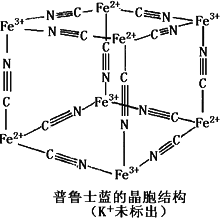
查看答案和解析>>
科目: 来源:福建师大附中2010-2011学年高二下学期期中考试化学试题 题型:022
已知X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.

请根据信息回答有关问题:
(1)元素Y的原子核外共有________种不同运动状态的电子,有________种不同能级的电子.
(2)X、Y、Z三种元素的第一电离能由高到低的排列次序依次为(写元素符号)________.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)________.
(4)R
的核外电子排布式为________.R的一种配合物的化学式为RCl3·6H2O.已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀.此配合物最可能是________.A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O
D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心原子为(写化学式)________,配位体为(写化学式)________,x的值为________.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为________.
查看答案和解析>>
科目: 来源:福建师大附中2010-2011学年高二下学期期中考试化学试题 题型:022
X、Y、Z均为短周期元素,可形成X2Z和YZ2两种化合物.X、Y、Z的原子序数依次增大,X原子的K层的电子数目只有一个,Y位于X的下一周期,它的最外层电子数比K层多2个,而Z原子核外的最外层电子数比次外层电子数少2个.
(1)它们的元素符号分别为X________;Y________;Z________;
(2)用价层电子对互斥理论判断:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com