
科目: 来源:广东省汕头市金山中学2011-2012学年高二上学期12月月考化学试题 题型:022
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种:还原沉淀法和电解法.还原沉淀法的工艺流程为:其中第①步存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
CrO![]()
![]() Cr2O
Cr2O![]()
![]() Cr3-
Cr3-![]() Cr(OH)3↓
Cr(OH)3↓
(1)若平衡体系的pH=2,则溶液显________色.
(2)能说明第①步反应达平衡状态的是________.
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至________.
查看答案和解析>>
科目: 来源:福建省厦门外国语学校2012届高三11月月考化学试题 题型:022
运用相关原理,回答下列各小题:
Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-.
(1)在NaHSO4溶液中c(H+)________c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH________7.
(2)将20 mL pH=2的NaHSO4溶液逐滴加入到20 mL 0.1 mol·L-1 Na2CO3溶液中,溶液中发生反应的离子方程式为:________;向此反应后的溶液中滴加0.001 mol·L-1 BaCl2溶液,首先析出的沉淀是________.[KSP(BaSO4)=1.1×10-10 mol2·L-2;KSP(BaCO3)=5.1×10-9 mol2·L-2]
Ⅱ.已知:在25时H2O![]() H++OH-KW=10-14
H++OH-KW=10-14
CH3COOH![]() H++CH3COO→Ka=1.8×10-5
H++CH3COO→Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为________.当升高温度时,Kh将________(填“增大”“减小”“不变”);
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为________,a与b的关系为________(填“大于”“小于”“等于”);
(5)0.9 mol·L-1醋酸钠溶液中[OH-]=________mol·L-1在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01 mol·L-1.向其中加入固体醋酸钠,使其浓度为0.9 mol·L-1,以上三种金属离子中________能生成沉淀,原因是________.
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14、![]() =2.2)
=2.2)
查看答案和解析>>
科目: 来源:河南省三门峡市2012届高三上学期调研考试化学试题 题型:022
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为________.利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2.当转移1.2 mol电子时,消耗的NO2在标准状况下是________L.
7N2+12H2O也可处理NO2.当转移1.2 mol电子时,消耗的NO2在标准状况下是________L.
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
①写出NO2氧化SO2
的热化学方程式________②
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________.a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________.
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.
CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.
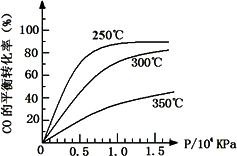
该反应ΔH________0(填“>”或“<”).实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是________.
查看答案和解析>>
科目: 来源:福建省南安一中2011-2012学年高二上学期期中考试化学理科试题 题型:022
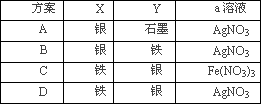
电解原理在化学工业中有广泛应用.右图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
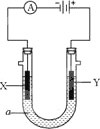
(1)X的电极名称是________(填写“阳极”或“阴极”).
(2)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是________,Y电极的材料是________.
(3)若X、Y都是惰性电极,a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是________,Y极上的电极反应式为________.
(4)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是________.
查看答案和解析>>
科目: 来源:福建省泉州一中2012届高三上学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省三明一中2012届高三11月学段考试化学试题 题型:022
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基础化工原料.铬常见价态有+3、+6价.铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如下:
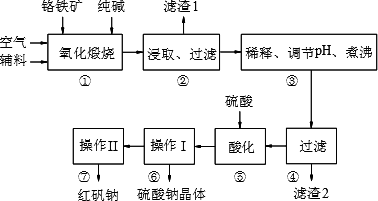
①中主要反应:4FeCr2O4+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
①中副反应有多个如:Al2O3+Na2CO3![]() 2NaAlO2+CO2↑等
2NaAlO2+CO2↑等
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式________.步骤“①”的反应器材质应选用________(填“瓷质”、“铁质”或“石英质”).请再写一个①中的副反应方程式________
(2)“②”中滤渣1的成分是________和________,“③”中调pH值是________(填“调高”或“调低”),“④”中滤渣2的成分是H2SiO3、Al(OH)3.
(3)若步骤2的溶液中加入过量的硫酸生成沉淀,则相关的离子方程式是:________.
(4)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,则操作Ⅰ是________,操作Ⅱ是________(填序号).
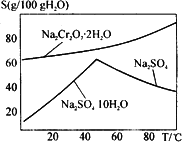
①蒸发浓缩,趁热过滤
②降温结晶,过滤
查看答案和解析>>
科目: 来源:重庆市重庆一中2011-2012学年高二上学期期中考试化学试题 题型:022
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
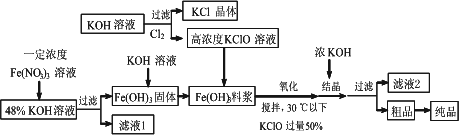
(1)上述氧化过程中,发生反应的离子方程式是:________,控制反应温度30℃以下的原因是:________.
(2)结晶过程中加入浓KOH溶液的作用是:________.
(3)根据图1、图2回答:为了获取更多的高铁酸钾,铁盐的质量分数应控制在________附近、反应时间应控制在________.

查看答案和解析>>
科目: 来源:北京市日坛中学2010-2011学年高一下学期期中考试化学试题 题型:022
下列各组物质中,互为同分异构体的是________,互为同系物的是________,是同一物质的是________,互为同素异形体的是________,互为同位素的是________.
A.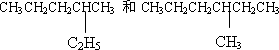
B.
C.![]()
D.
E.35Cl和37Cl
F.金刚石和石墨
查看答案和解析>>
科目: 来源:山东省潍坊市重点中学2011年新高二暑假作业(四)化学试题 题型:022
同学们已经学习了同位素、同系物、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表.
①![]() 和
和![]()
②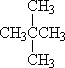 和
和![]()
③CH4和CH3CH2CH3;
④金刚石和石墨:
⑤H、D、T;
⑥16O、17O、18O;
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑧臭氧(O3)和氧气(O2).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com