
科目: 来源:湖南省师大附中2011-2012学年度高二上学期期中考试化学试题(人教版) 题型:022
甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”).
查看答案和解析>>
科目: 来源:江苏省淮安七校2011-2012学年高二上学期期中考试化学试题(选修) 题型:022
由等物质的量烃A和烃的衍生物B组成的混合物共0.5摩,恰好能和1.25摩O2完全燃烧生成1 mol CO2和1 mol H2O,请用分子式给出A和B的可能组合方式(可不填满)
查看答案和解析>>
科目: 来源:江苏省江都市育才中学2011-2012学年高二上学期期中考试化学试题(选修) 题型:022
请根据官能团的不同对下列有机物进行分类.

(1)芳香烃:________;
(2)卤代烃:________;
(3)醇:________;
(4)酚:________;
(5)醛:________;
(6)酮:________;
(7)羧酸:________;
(8)酯:________.
查看答案和解析>>
科目: 来源:江苏省启东中学2012届高三第二次月考化学试题 题型:022
工业上生产高氯酸(沸点:90℃)时还同时生产了亚氯酸钠,其工艺流程如下:
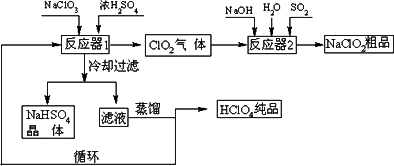
(1)冷却过滤的目的是降低NaHSO4的________并分离出NaHSO4晶体.
(2)反应器2中发生反应的离子方程式为________.SO2的作用是作________剂.
(3)循环使用的物质是________.
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是________.
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)________.
查看答案和解析>>
科目: 来源:安徽省舒城皖智高考复读学校2012届高三12月第一次旬考化学试题 题型:022
下列三组物质中,均有一种物质的类别与其它三种不同
A.MgO、Na2O、CO2、CuO
B.HCl、H2O、H2SO4、HNO3
C.NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):A________;B________;C________.
(2)A、B、C三种物质相互作用可生成一种新物质,该反应________氧化还原反应(填“是”或“不是”).这种新物质与盐酸反应的离子方程式为________.
查看答案和解析>>
科目: 来源:黑龙江省大庆实验中学2010-2011学年高二上学期期末考试化学试题 题型:022
(1)有下列各组物质:
A.O2和O3
B.12C和13C
C.CH3CH2CH2CH3和CH3CH(CH3)CH3
D.CH3CH2CH2CH![]() CH2和CH2
CH2和CH2![]() CHCH2CH2CH3
CHCH2CH2CH3
E.甲烷和辛烷
(1)互为同位素的是________;
(2)互为同素异形体的是________;
(3)互为同系物的是________;
(4)是同一种物质的是________.
 的系统名称为________.
的系统名称为________.
查看答案和解析>>
科目: 来源:上海市长宁区2012届高三上学期期末质量抽测化学试题 题型:022
有机物的结构也可用键线式表示.如:

1.具有相同碳原子数的环烷烃与________是同分异构体.
2.![]() 的分子式为________;
的分子式为________;
3.乙炔3分子聚合的产物为苯.写出丙炔三分子聚合形成的芳香烃分子的键线式________.
4.由![]() 以及必要的无机试剂可合成
以及必要的无机试剂可合成![]() ,写出第一步合成反应的化学方程式________.
,写出第一步合成反应的化学方程式________.
5.![]() 的一种同分异构体A,它的一氯代物有三种.与Br2按1∶1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为________.
的一种同分异构体A,它的一氯代物有三种.与Br2按1∶1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为________.
查看答案和解析>>
科目: 来源:河南省卢氏一高2012届高三上期期末调研考试化学试题 题型:022
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度( s,mol·L-1)见下图.
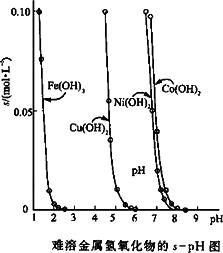
(1)pH=3时溶液中铜元素的主要存在形式是:________(化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为________
A.<1
B.4左右
C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(能、不能)通过调节溶液pH的方法来除去,理由是________.
(4)已知一些难溶物的溶度积常数如下表.
![]()
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的________除去它们.
A.NaOH
B.FeS
C.Na2S
查看答案和解析>>
科目: 来源:江苏省仪征中学2011-2012学年高二上学期期末模拟考试化学试题(选修) 题型:022
按题给要求填空
(1)按官能团的不同,可将有机物分为
A.烷烃
B.烯烃
C.炔烃
D.醚
E.酚
F.醛
G.羧酸
H.苯的同系物
I.酯
J.卤代烃
K.醇等,请指出下列有机物的种类(填写字母).
①CH3CH2CH2CHO________;
②![]() ________;
________;
③![]() ________;
________;
④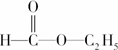 ________;
________;
⑤![]() ________;
________;
⑥![]() ________.
________.
(2)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为________.
查看答案和解析>>
科目: 来源:江苏省栟茶高级中学2012届高三上学期第二次调研测试化学试题 题型:022
以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表.
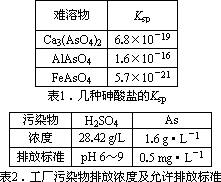
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=_________mol·L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=_________,若混合溶液
中Al3+、Fe3+的浓度均为1.0×10-4 mol·L-1,c(AsO43-)的最大是_________mol·L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式_________.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_________;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com