
科目: 来源:物理教研室 题型:058
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.

(1)如果把电键K接A,该装置应是 ________,Zn①极是________极,电极反应为________,Zn②极是________极,电极反应为_______.
(2)上述反应进行5min后,转换电键K到C,则这一装置是________,Zn①极是极,电极反应式是________,Zn②极是________极,电极反应式是________.
(3)上述装置进行2min后,再转换电键K到B,则Zn①极发生的化学反应为________,Zn②极发生的有关电化学的反应为________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
1991年我国首创以铝——空气——海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就会发出耀眼的白光,则电源负极材料为:________,正极材料为:________.正极反应为:________;负极反应为________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
在一个容积固定的反应器中,有一个可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B和C均为:4.0mol,D为6.5mol,F为2.0mol,设E为xmol.当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置.
请填写以下空白:
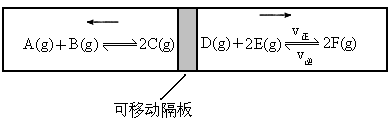
(1)若x=4.5,则右侧反应在起始时向________(填“正反应”或“逆反应”)方向进行.欲使起始反应维持向该方向进行,则x的最大取值应小于________.
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?________(填“相等”、“不相等”或“不能确定”).其理由是_________________________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
对于密闭容器中进行的反应: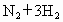
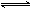
 ,温度不变时:①若容器体积不变,通入
,温度不变时:①若容器体积不变,通入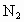 ,则平衡________移动;通入惰性气体(指不与混合体系中物质反应的气体),则平衡________移动.②若容器中气体的压强保持不变,则通入惰性气体时,平衡________移动.
,则平衡________移动;通入惰性气体(指不与混合体系中物质反应的气体),则平衡________移动.②若容器中气体的压强保持不变,则通入惰性气体时,平衡________移动.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB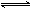 cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了n/2mol,C增加了3n/2mol,D增加了nmol,此时达到化学平衡.
cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了n/2mol,C增加了3n/2mol,D增加了nmol,此时达到化学平衡.
(1)该化学方程式中各物质的化学计量数为a=________、b=________、c=________、d=________;
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A________、B________、D________.
(3)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”).
查看答案和解析>>
科目: 来源:物理教研室 题型:058
A、B、C三种元素为短周期元素.A元素的阴离子不能被任何氧化剂氧化,则A离子的电子式为________.1molB单质能从盐酸中置换3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B离子的结构示意图为________,B的最高价氧化物对应的水化物的化学式为________.C元素有3个电子层,且最外电子层比次外电子层少2个电子,则C元素是________,C与钠反应生成的化合物中的化学键类型是________,该化合物的形成过程是(用电子式表示)________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
在一定条件下A与B反应可生成C与D,其能量变化如下所示:
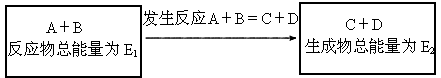
(1)若,反应体系的总能量(“升高”、“降低”)________,为(“吸热”、“放热”)________反应,其原因是________.
(2)若,反应体系的总能量(“升高”、“降低”)________,为(“吸热”、“放热”)________反应,其原因是________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
氮化钠(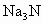 )是一种重要的化合物,它与水反应可产生
)是一种重要的化合物,它与水反应可产生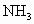 .请回答下列问题:
.请回答下列问题:
(1)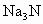 的电子式是________,该化合物是由________键形成.
的电子式是________,该化合物是由________键形成.
(2)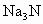 与盐酸反应生成________种盐,其电子式是________.
与盐酸反应生成________种盐,其电子式是________.
(3)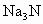 与水的反应属于________反应.
与水的反应属于________反应.
(4)比较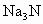 中两种微粒的半径:
中两种微粒的半径: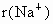 ________
________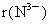 (填写“<”、“=”、“>”).
(填写“<”、“=”、“>”).
查看答案和解析>>
科目: 来源:物理教研室 题型:058
A、B、C、D、E是中学化学常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子.它们之间可发生如下变化:A+B=C+D,B+E=2D,且D与大多数酸性氧化物及碱性氧化物均能反应.
(1)A的电子式为________;E的电子式为________.
(2)B的化学式为________;C的化学式为________;D的化学式为________;E的化学式为________.
(3)用电子式表示D的形成过程:________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为(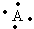 ),B原子L层的电子数是K层的3倍;0.1molC单质能从酸中置换出2.24L氢气(标准状况),同时它变成Ne原子的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
),B原子L层的电子数是K层的3倍;0.1molC单质能从酸中置换出2.24L氢气(标准状况),同时它变成Ne原子的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)写出A、B、C、D四种元素的名称:
A________、B________、C________、D________.
(2)D元素在周期表中属________周期________族.
(3)用电子式表示A的气态氢化物的形成过程_________,该分子是________分子.(“极性”、“非极性”)
(4)A和B的单质充分反应生成“化合”物的结构式是________,属于________分子.(“极性”、“非极性”)
(5)四种元素中,________的最高价氧化物的水化物既能溶于酸、又能溶于碱,溶于NaOH溶液的化学方程式为:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com