
科目: 来源:物理教研室 题型:058
在浓硝酸中放入铜片:
(1)开始反应的化学方程式为______________,实验现象为___________.
(2)若铜有剩余,则反应将要结束时的反应的离子方程式为____________.
(3)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况).则所消耗的硝酸的物质的量是_____________,所得气体的相对分子质量为_____________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用如图的工艺流程生产单质碘:

(1)乙、丁中溶质的化学式:乙______________,丁_______________.
(2)第④步操作中用稀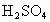 浸洗的目的是___________(填写字母编号).
浸洗的目的是___________(填写字母编号).
a.除去未反应的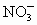
b.除去未反应的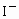
c.除去未应的Fe
d.除去碱性物质
(3)第⑦步操作可供提纯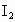 的两种方法是___________和_________.(不要求写具体步骤)
的两种方法是___________和_________.(不要求写具体步骤)
(4)实验室检验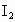 的方法是__________.
的方法是__________.
(5)甲物质见光易变黑,其原因是(用化学方程式表示)________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
某硫酸厂周围的空气含有较多的二氧化硫,为了测定空气中二氧化硫的体积分数做了如下实验:取上述标准状况下的空气1L(内含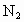 、
、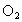 、
、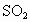 、
、 )慢慢通过足量溴水,然后在此溶液中加入过量的
)慢慢通过足量溴水,然后在此溶液中加入过量的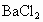 溶液,产生白色沉淀,将沉淀洗净、干燥后称量为0.233g.试回答:
溶液,产生白色沉淀,将沉淀洗净、干燥后称量为0.233g.试回答:
(1)通入足量溴水的目的是____________________.
(2)加入过量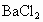 溶液的目的是__________________.
溶液的目的是__________________.
(3)过滤后,若在滤液中加入 溶液.有白色沉淀产生,能说明:
溶液.有白色沉淀产生,能说明:
___________________________________________.
(4)用蒸馏水洗涤沉淀2~3次,若在洗液中加入 溶液,无沉淀出现,能说明:__________________________________.
溶液,无沉淀出现,能说明:__________________________________.
(5)空气中,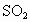 的体积分数为_________________________.
的体积分数为_________________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
分别向盛有①紫色石蕊溶液; ②NaOH溶液; ③品红溶液; ④酸性 溶液的试管中通入
溶液的试管中通入 气体.
气体.
(1)试管①中的现象是______________,
发生反应的化学方程式为____________.
(2)试管②中现象是_______________,
发生反应的化学方程式为____________,如果人过量的 ,则发生反应的化学方程式为__________________.
,则发生反应的化学方程式为__________________.
(3)试管③中的现象是___________,如将吸收 的该溶液加热,现象是__________________.
的该溶液加热,现象是__________________.
(4)试管④中的现象是__________,配平反应的化学方程式:
____________ +_______________
+_______________ +_________
+_________
______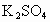 +_____________
+_____________ +________________
+________________ .
.
(5)上述实验中 表现出酸性氧化物性质的是__________(填试管标号,同),
表现出酸性氧化物性质的是__________(填试管标号,同), 表现出漂白性的是_______________,
表现出漂白性的是_______________, 表现出还原性的是___________________.
表现出还原性的是___________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
用图中的简易装置可以进行气体的制取和收集.
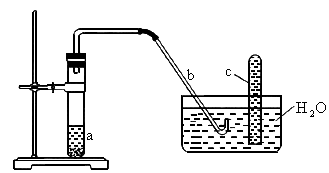
(1)实验前应如何检查装置的气密性?答:________________________.
(2)拔开试管a的橡皮塞,加入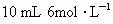 的稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口,反应开始时速度缓慢,逐渐加快.请写出试管a中发生的所有反应的化学方程式:______________________.
的稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口,反应开始时速度缓慢,逐渐加快.请写出试管a中发生的所有反应的化学方程式:______________________.
(3)从应开始到反应结束,预期在试管a中可观察到哪些现象?请依次逐一写出.
_____________________________________________________________.
(4)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出.试说明反应开始时,导管中水面先上升的原因.
____________________________________________________________.
(5)试管c收集满气体后,用拇指堵住管口,离开水槽.将管口向上,松开拇指,片刻后,再次堵住管口,将试管又倒置在水槽中,松开拇指.此时可观察到什么现象?
_____________________________________________________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
实验室用如图所示装置制取乙酸乙酯.

(1)在大试管中配制一定比例的乙醇、乙酸和浓 的混合溶液的方法是:_______________________________.
的混合溶液的方法是:_______________________________.
(2)加热前,大试管中加入几粒碎瓷片的作用是_____________;导气管不能插入饱和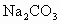 溶液中是为了:_______________.
溶液中是为了:_______________.
(3)浓 的作用是:①___________;②______________.
的作用是:①___________;②______________.
(4)饱和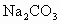 溶液的作用是____________.
溶液的作用是____________.
(5)实验生成的乙酸乙酯,其密度比水____________(填“大”或“小”),有气味.
(6)该实验的主要反应的化学方程式是:_________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
实验室制乙烯,常因温度过高而使烧瓶中液体变黑.为了验证被硫酸氧化确实有二氧化碳气体生成,某同学设计如图所示的A、B、C三个装置进行实验(乙醇与浓硫酸的反应装置省略,并假设装置C中的反应完全).请回答:
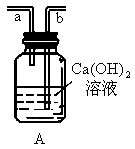


(1)装置B的作用是______________;
(2)三个装置之间的连接顺序是(填写导管口序号a、b、c、d、e、f):
气体发生装置导管口接________,然后________接_________,_________接_________;
(3)装置A、B、C中各有什么现象?
A中__________,B中___________,C中_________;
(4)乙醇与浓硫酸反应的装置与制取____________气体的装置相同;
(5)为了防止制得气体不纯,是否可以把温度控制在较低(140℃)情况下进行反应?为什么?
查看答案和解析>>
科目: 来源:物理教研室 题型:058
铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法.

首先检查制氧装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮.试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于___________.能表示其原理的反应方程式为______________.
(2)仪器A的名称为__________,其中装的药品可以是_________,其作用是__________.
(3)由实验可知,该类铁生锈的条件为___________.决定铁生锈快慢的一个重要因素是____________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
按图所示装置连接好仪器.
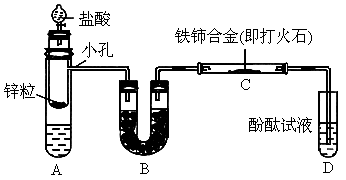
已知:A中装有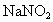 和
和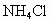 混合溶液,B中装有碱石灰,C中有铁铈合金,D中有酚酞试液.
混合溶液,B中装有碱石灰,C中有铁铈合金,D中有酚酞试液.
C中发生反应的热化学方程式为: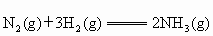 ;
;
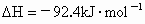
实验步骤如下:①检查装置的气密性;②用酒精灯加热 和
和 饱和溶液,待有气体生成,可停止加热,但仍有大量气体产生;③再用酒精灯给铁铈合金加热至一定温度;④从分液漏斗中滴入一定浓度盐酸,不久见酚酞试液变红.
饱和溶液,待有气体生成,可停止加热,但仍有大量气体产生;③再用酒精灯给铁铈合金加热至一定温度;④从分液漏斗中滴入一定浓度盐酸,不久见酚酞试液变红.
回答下列问题:
(1)写出A中两溶液间发生反应的化学方程式________,此反应为________热反应(填“放”或“吸”);
(2)先用酒精灯加热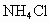 、
、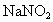 饱和溶液的目的是______________;
饱和溶液的目的是______________;
(3)C中铁铈合金的作用是______________,要先加热至一定温度的原因是______________;
(4)如果通入C中的 、
、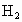 各有1 mol、3 mol,为什么反应后放出的热量比92.4 kJ少?
各有1 mol、3 mol,为什么反应后放出的热量比92.4 kJ少?
查看答案和解析>>
科目: 来源:物理教研室 题型:058
晶胞是晶体中最小重复单位,并在空间不断伸展构成晶体.NaCl晶体是一个正六面体如图.我们把阴、阳离子看成不等径的圆球,并彼此相切,离子键的键长是相邻阴阳离子的半径之和(如图).已知a为常数,请计算下列问题:

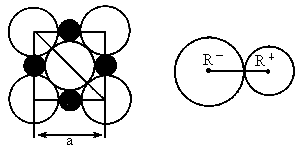
(1)每个晶胞中平均分摊___________个 ,__________个
,__________个 .
.
(2)若某NaCl晶体的质量为5.85克,它约含__________摩尔NaCl晶胞.
(3)NaCl晶体离子键的键长为_______, 半径与
半径与 半径之比为=_________.
半径之比为=_________.
(4)NaCl晶体中不存在分子,但在高温下(≥1413℃时)晶体转变成气体NaCl,以分子形式存在,现有1mol NaCl晶体,加强热使其汽化,测得气体体积为11.2升(已折为标准状况).则此时氯化钠气体的分子式为_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com