
科目: 来源:贵州省铜仁一中2011届高三第四次月考化学试题 题型:058
某化学课外小组设计了如下图(铁架台均已略去)所示的实验装置,进行气体性质实验.图中用箭头表示气体流向,A表示一种纯净、干燥的气体,B表示另一种气体.反应进行一段时间后,装置己中有红棕色气体生成.实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水.
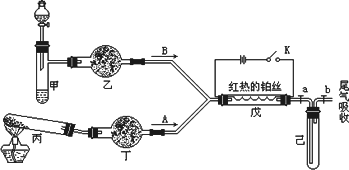
根据图中装置和反应现象请回答:
(1)丙中发生反应的化学方程式为________.
(2)丁中的干燥剂应选________,不选另一种干燥剂的理由是________.
(3)甲中发生反应的化学方程式为________.
(4)戊中发生的主要反应的化学方程式为________,此反应是(吸热、放热)________反应,可能发生的什么现象可以证明你的判断________.
查看答案和解析>>
科目: 来源:浙江省嘉兴市第一中学2011届高三第一次月考化学试题 题型:058
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.
(1)全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1.其工业提取法有:
Ⅰ、空气吹出纯碱吸收法.方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴.该方法涉及的反应有:
①________(写出离子方程式);
②3Br2+3CO32-![]() BrO3-+5Br-+3CO2↑;
BrO3-+5Br-+3CO2↑;
③________(写出离子方程式).
其中反应②中氧化剂是________,还原剂是________.
Ⅱ、空气吹出SO2吸收法.该方法基本同(1),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴.
写出溴与二氧化硫反应的化学方程式________.
Ⅲ、溶剂萃取法.该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的.
实验室中萃取用到的实验仪器名称是________.
下列可以用于海水中溴的萃取的试剂是________.①乙醇,②四氯化碳,③硝酸
(2)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO.其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO.
下图为“硫化氢-水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线.写出100℃时所发生的反应的化学方程式________;工业上富集HDO的生产过程中,可以循环利用的一种物质是________.
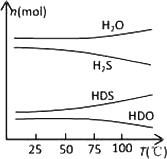
查看答案和解析>>
科目: 来源:福建省南平市政和一中2011届高三上学期第二次月考化学试题 题型:058
现有一定量含有
Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度.(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)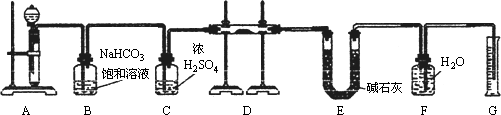
回答下列问题:
(1)装置
A中液体试剂选用________,理由是________.(2)装置
B的作用是________.装置
C的作用是________.装置
E中碱石灰的作用是________.(3)装置
D中发生反应的化学方程式是________.(4)
若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________.查看答案和解析>>
科目: 来源:安徽省合肥八中2011届高三第二次月考化学试题 题型:058
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江西省吉安一中2010-2011学年高三开学模拟考试化学试题 题型:058
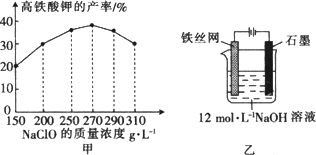
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景.其制备路线如下:
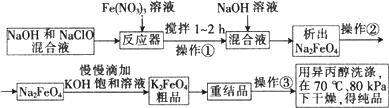
试回答下列问题
(1)操作①搅拌的目的是:________.
(2)操作②与操作③相同,该操作名称是:________.
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为:________.
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为________.(计算结果保留一位小数)
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为________.
查看答案和解析>>
科目: 来源:导学大课堂必修二化学人教版 人教版 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:必修一导学指导化学苏教版 苏教版 题型:058
工业纯碱中常含有少量的NaCl等杂质,下图中的仪器装置可用来测定纯碱中Na2CO3的质量分数,图中标号:①空气;②某溶液;③纯碱样品;④稀H2SO4;⑤浓H2SO4;⑥碱石灰;⑦碱石灰.
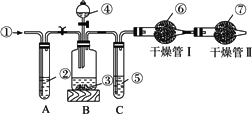
实验步骤:
①检验装置的气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1g);
③准确称量一定量的纯碱的质量(设为m2g),并将其放入广口瓶中;
④从分液漏斗中缓缓滴入稀H2SO4,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为m3g).
根据以上实验,回答下列问题:
(1)鼓入空气的目的是________.
(2)装置A中液体应用,其作用是________,如撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将________(填“偏大”“偏小”或“不变”).
(3)装置C的作用是________,如果撤去C,则会导致实验结果________(填“偏大”“偏小”或“不变”)
(4)干燥管Ⅱ的作用是________.
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是________,如果这两步操作太快,则会导致实验测定结果________(填“偏大”“偏小”或“不变”).
(6)根据实验,纯碱中Na2CO3的质量分数的计算式为________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
由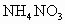 和
和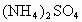 的混合物形成水溶液,经测定a L.该混合液与某浓度的氢氧化钠溶液反应时,当消耗占b mol NaOH时,刚好使
的混合物形成水溶液,经测定a L.该混合液与某浓度的氢氧化钠溶液反应时,当消耗占b mol NaOH时,刚好使 全部逸出;若a L该混合液与某浓度的
全部逸出;若a L该混合液与某浓度的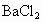 溶液反应,当消耗
溶液反应,当消耗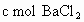 时,刚好沉淀完全.则该混合溶液中,
时,刚好沉淀完全.则该混合溶液中,
(1)原混合液中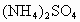 的物质的量浓度为_______________.
的物质的量浓度为_______________.
(2)原混合液中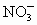 的物质的量为________________________.
的物质的量为________________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
Ⅰ.(1)用已准确称量的1.06g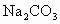 固体配制
固体配制![]() 溶液100 mL,所需要的仪器为:________________________________.
溶液100 mL,所需要的仪器为:________________________________.
(2)除去 固体中?昆有的少量
固体中?昆有的少量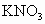 ,所进行的实验操作依次为___________、蒸发、结晶、____________.
,所进行的实验操作依次为___________、蒸发、结晶、____________.
(3)除去KCl溶液中的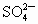 ,依次加入的溶液为(填溶质的化学式)______________.
,依次加入的溶液为(填溶质的化学式)______________.
Ⅱ.粉末状试样A是由等物质的量的MgO和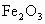 组成的混合物.进行如下实验:
组成的混合物.进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 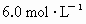 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标准标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色.
请填空:
(1)①中引发铝热反应的实验操作是______________,产物中的单质B是______________.
(2)②中所发生的各反应的化学方程式是________________.
(3)③中所发生的各反应的离子方程式是________________.
(4)若溶液D的体积仍视为0.15 L则该溶液中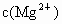 为_________,为____________________.
为_________,为____________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:058
某银白色金属A,它的原子的电子层数与最外层电子数相等.在一定条件下A可以分别跟盐酸、氢氧化钠溶液和水反应,生成B、C、D,同时都有氢气生成,B.C、D在一定条件下,又可以相互转变,它们的变化如图所示,判断A,写出A、B、C、D物质间相互转化的离子方程式:A为___________;

(1)A B:_______________________________________________;
B:_______________________________________________;
(2)A C:______________________________________________;
C:______________________________________________;
(3)B C:______________________________________________;
C:______________________________________________;
(4)C B:______________________________________________;
B:______________________________________________;
(5)B D:______________________________________________;
D:______________________________________________;
(6)D B:______________________________________________;
B:______________________________________________;
(7)C D:______________________________________________;
D:______________________________________________;
(8)D C;______________________________________________.
C;______________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com