
科目: 来源: 题型:013
某学生仅有如下仪器和用具:烧杯、铁架台、铁圈、三脚架、漏斗、分液漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴.从缺乏仪器的角度看,不能进行的实验项目是
[ ]
查看答案和解析>>
科目: 来源: 题型:013
通过水溶解、过滤、蒸发等操作,可将下列各组混合物分离的是
[ ]
A.硝酸钠、氢氧化钠
B.氧化铜、二氧化锰
C.氯化钾、二氧化锰
D.硫酸铜、氢氧化钙
查看答案和解析>>
科目: 来源: 题型:013
鉴别氧气、氢气、二氧化碳三种气体的方法是
[ ]
A.使气体分别通过灼热的氧化铜
B.用燃着的木条检验
C.使气体分别通人澄清的石灰水
D.使气体分别通过炽热的铜网
查看答案和解析>>
科目: 来源:江苏省扬州中学2011-2012学年高二下学期期中考试化学试卷 题型:058
MnSO4·H2O在工业、农业等方面有广泛的应用.
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下:

已知:常温时部分硫化物难溶盐的Ksp:CuS——6.3×10-36、PbS——1.0×10-28、NiS——2.0×10-26、MnS——2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是________.
(2)浸出和还原过程中发生的主要离子反应方程式为________.
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5 mol/L,则c(S2-)最大=________mol/L.
(二):性质-热稳定性:MnSO4·H2O在1150℃高温下分解的产物是Mn3O4、SO2、SO3和水,在该条件下硫酸锰晶体分解反应的化学方程式是________.
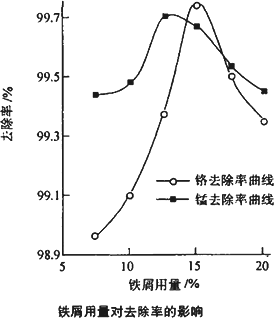
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响
(1)取100 mL废水于250 mL锥形瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图所示.则在pH一定时,废水中铁屑用量为________时锰、铬去除率最好.
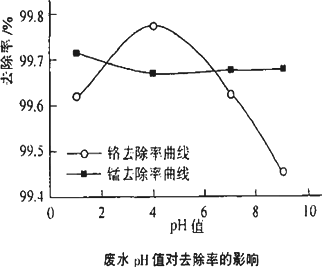
(2)取100 mL废水于250 mL锥形瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如下图所示.则在铁屑用量一定时,废水pH=________时锰、铬去除率最好.
查看答案和解析>>
科目: 来源:福建省永定一中2011-2012学年高二下学期第一次阶段考化学试题 题型:058
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子).
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤II所得溶液中加入过量氨水.
已知:金属离子氢氧化物沉淀所需pH
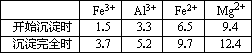
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是________(填字母序号).
A.MgO
B.Na2CO3
C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN)6])溶液不变色所需H2O2溶液的量来确定粗硫酸镁中Fe2+的含量.已知,测定123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2溶液的体积如下表所示.
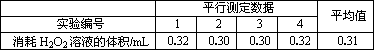
Fe2+与H2O2溶液反应的离子方程式为________.
(3)工业上常以Mg2+的转化率为考察指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.
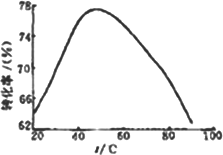
①根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是________(填“吸热”或“放热”)反应.
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是________.
③Ksp表示沉淀溶解平衡的平衡常数.已知:
Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq) Ksp=c(Mg2+)·c2(OH-)=5.6×10-12
Mg2+(aq)+2OH-(aq) Ksp=c(Mg2+)·c2(OH-)=5.6×10-12
Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) Ksp=c(Ca2+)·c2(OH-)=4.7×10-6
Ca2+(aq)+2OH-(aq) Ksp=c(Ca2+)·c2(OH-)=4.7×10-6
若用石灰乳替代氨水,________(填“能”或“不能”)制得氢氧化镁,理由是________.
查看答案和解析>>
科目: 来源:江苏省上冈高级中学2011-2012学年高二上学期期中考试化学试题(选修) 题型:058
化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成.
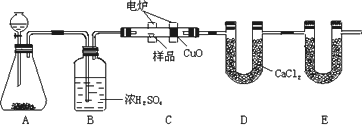
回答下列问题:
(1)装置A中装有MnO2,写出A装置中发生反应的化学方程式是________;
(2)C装置(燃烧管)中CuO的作用是________;
(3)写出E装置中所盛放物质的名称________,它的作用是________.
(4)若将B装置去掉会对实验结果造成什么影响?________.
(5)若准确称取1.20 g样品(烃或烃的含氧衍生物).经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的实验式为________.
(6)从定量测定准确角度去考虑,该装置应怎样进一步改进________.
查看答案和解析>>
科目: 来源:江苏省无锡市洛社中学2011-2012学年高二上学期期中考试化学试题(选修) 题型:058
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子式组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出).请回答有关问题:

(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的氧气,这样做的目的是________,之后关闭止水夹a.
(2)由装置B、C可分别确定待测氨基酸中含有的________和________质量.
(3)E装置的作用是测量________的体积,并由此确定待测氨基酸中含有的________.
的质量,为了较准确地测量该气体的体积,在读反应前后甲管中液面的读数求其差值的过程中,应注意________(填代号).
a、视线与凹液面最低处相平
b、等待片刻,待乙管中液面不再上升时,立刻读数
c、读数时应上下移动乙管,使甲、乙两管液面相平
d、读数时不一定使甲、乙两管液面相平
(4)实验中测定的哪一数据可能不准确________,其理由是________.
(5)严格地说,按上述方案只能确定氨基酸的________.
若要确定此氨基酸的分子式,还要测定该氨基酸的________.
查看答案和解析>>
科目: 来源:2011年高考化学总复习30分钟限时训练:专题12 化学与自然资源的开发利用 题型:058
海洋中含有丰富的资源,是人类的巨大宝库.我国拥有很长的海岸线,东部沿岸海滩平缓,多细沙,日照时间长,不少盐场均集中于此.回答下列问题:
(1)制海盐方法如下:海水涨潮时,将海水引入盐田,等落潮时,再用日晒的方法,待盐田水分蒸发到一定程度时,再撒入食盐颗粒(称为晶种),食盐晶体即从饱和溶液中析出.请说明盐田获得食盐晶体的条件________.
(2)以食盐为主要原料可以制备纯碱.试用化学方程式表示其制备过程:
________.
此法制得的纯碱中常含有少量氯化钠,要测定样品中的纯碱的质量分数,还可采用下图中的装置进行实验:
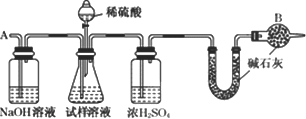
请你用一句话叙述该实验设计的基本原理:________.
(3)氯碱化工厂制得的烧碱中也含有少量氯化钠(假设不含其他杂质),用中和滴定法设计一个实验方案以测定样品中烧碱和氯化钠的质量分数.试剂是0.100 0 mol/L盐酸、酚酞溶液,仪器是50 mL的酸式滴定管、锥形瓶.其实验的主要步骤是________、________、滴定.
(4)工业上用电解法制备金属钠,但制备金属钾一般不采用电解熔融氯化钾,而是采用热还原法来制备.在850℃用金属钠来还原KCl反应如下:
Na(液)+KCl(液)![]() NaCl(液)+K(气).
NaCl(液)+K(气).
工业上应采用哪些措施才能使反应向正反应方向移动?
________.
查看答案和解析>>
科目: 来源:福建省厦门六中2010-2011学年高二下学期期中考试化学试题 题型:058
某工业纯碱中含有少量NaCl和NaOH.学生课外活动小组为测定其中Na2CO3的质量分数,采样进行分析.通过集体讨论,选择下列适当装置连接,对设计方案不断完善,成功地完成了测定实验.
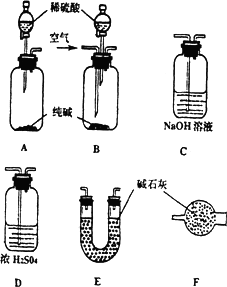
下面是甲、乙、丙、丁、戊五位同学有关设计实验装置的讨论发言.请在空白处填写他们的发言内容:
甲:将装置A和E连接即可.因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,通过分别测量反应前和反应后E的总质量,可求出Na2CO3的质量分数.
乙:还应在A和E之间连接装置________(填序号),其目的是:________
丙:应该用B装置取代A.从B装置的导管口处缓缓鼓入空气,其目的是:________
丁:由于空气中含有CO2,若直接向B装置鼓入空气会导致实验测定结果________(填“偏高”、“偏低”或“无影响”).因此,应将鼓入的空气先通过装置________.
戊:E装置后还应连接装置F,其作用是________
学生课外活动小组测定的数据如下:
![]()
计算该工业纯碱中Na2CO3的质量分数为:________
[相对原子质量:C-12 O-16 Na-23]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com