
科目: 来源: 题型:022
我国报道的高温超导材料中,铊(Tl)是组成成分之一.已知铊和铝是同一
主族元素,原子序数为81,请回答关于该元素的几个问题:
(1)铊的金属性比铝强还是比铝弱?
(2)铊的最外层电子数为多少?
(3)铊位于周期表中的第几主族?
(4)铊通常形成的化合价是多少?写出它的氯化物的化学式.
(5)铊的最高价氧化物的水化物的化学式是怎样的?它的最高价氧化物的水化物是否与氢氧化铝一样是两性氢氧化物?
(6)铊与水或酸反应生成氢气的能力比铝强还是比铝弱?
查看答案和解析>>
科目: 来源: 题型:022
有A、B、C、D四种元素,A、B两原子有相同的电子层数,A元素只有正价,B元素既可显正价又可显负价,则A、B两元素中,原子半径较大的是___________原子,最外层电子数较多的是__________原子;若C原子和A原子有相同的最外层电子数,C的原子半径较大,则A、C两原子还原性较强的是___________;若D原子与B原子最外层电子数相同,B原子半径小于D,则B、D两原子中氧化性较强的是_______.
查看答案和解析>>
科目: 来源: 题型:022
W、X、Y、Z四种元素都位于短周期内,它们的原子序数依次递增.W原子核内仅有一个质子,X原子的电子总数与Z原子的最外层电子数相等,W原子与X原子的最外层电子数之和与Y原子的最外层电子数相等.Z原子L层电子数是K.层电子数的3倍,且Z只能形成阴离子.由此推断它们的元素符号是:W______X______Y______Z______.已知W、X、Y、Z可组成一种化合物,其原子个数之比为4∶1∶2∶l,该化合物的名称是______.
查看答案和解析>>
科目: 来源: 题型:022
a、b、c、d、e、f、s为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
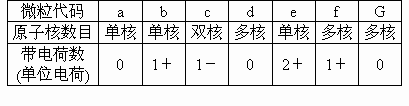
其中b的离子半径大于e的离子半径;d是溶于水显碱性的四原子分子;c与f作用可生成2个中性分子g.
试写出:
(1)a微粒的原子结构示意图为__________.
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:________,>_______(用化学式表示).
(3)d溶于水的电离方程式为______.
(4)c微粒是______,f微粒是______(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为______.
查看答案和解析>>
科目: 来源: 题型:022
周期表前20号元素中有A、B、C、D、E五种元素.已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族,A与C、B与E原子的电子层数都相差2,A、B原子最外层电子数之比为1∶4.
(1)写出元素符号:B______、D______、E______.
(2)A和C能以原子数1∶1形成一种化合物,写出该化合物的化学式:______.
查看答案和解析>>
科目: 来源: 题型:022
已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z.元素Y、X、Z的原子序数依次递增.
②X在A、B、C、D中都不呈现它的最高化合价.
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C.
④化合物D受热催化分解,可制得元素Y的单质.
(1)元素X是______,Z是______.
(2)写出③中反应的化学方程式:______.
(3)写出④中反应的化学方程式:______.
查看答案和解析>>
科目: 来源: 题型:022
19世纪中叶,门捷列夫总结了如图所示的元素化学性质的变化状况.试回答:

(1)门捷列夫的突出贡献是
[ ]
A.提出了原子学说
B.提出分子学说
C.发现元素周期律
D.发现能量守恒定律
(2)该图表变化表明
[ ]
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是得电子能力最强的元素
C.IA族元素的失电子能力肯定比同周期ⅡA族元素的失电子能力强
D.物质发生量变到一定程度必然引起质变
(3)按照图表中元素的位置,认真观察从ⅢA族的硼到ⅦA族的砹连接的一条折线,我们能从分界线附近找到
[ ]
A.耐高温材料
B.新型农药材料
C.半导体材料
D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子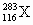 ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
[ ]
A.这种原子的中子数为167
B.它位于元素周期表中第6周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合
查看答案和解析>>
科目: 来源: 题型:022
有X、Y、Z、W四种短周期元素,其原子序数依次增大,其核电荷数总和为38,Y元素原子最外?层电子占核外总电子数的 ;W元素原子最外层电子数比同周期Z元素多5个电子,W和Y不属同一主族.
;W元素原子最外层电子数比同周期Z元素多5个电子,W和Y不属同一主族.
(1)写出元素符号:X______、Y______、Z______、W______.
(2)Z、W两元素的最高价氧化物的水化物间反应的化学方程式为___________.
(3)这四种元素组成的一种化合物的化学式是___________.
查看答案和解析>>
科目: 来源: 题型:022
A、B、C、D四种短周期元素的原子序数依次增大.A、D同族,B、C同周期.A、B组成的化合物甲为气态,其中A、B原子数之比为4∶1.由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子数之比为1∶1,丙中为2∶1.由D、C组成的两种化合物丁和戊都为固态,丁中D、C原子数之比为1∶1,戊中为2∶1.
(1)写出分子式:甲________、乙________、丙________、丁________、戊________.
(2)写出B元素的最高价氧化物跟丁发生反应的化学方程式:__________.
查看答案和解析>>
科目: 来源: 题型:022
A、B、C、D、E为原子序数依次增大的短周期元素.已知A、B、E三原子最外层有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素符号:A______、C______、D______;
(2)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式__________;A、E两元素最高价氧化物的水化物相互反应的化学方程式__________;
(3)比较C、D最高价氧化物对应水化物的酸性__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com