相关习题
0 95337 95345 95351 95355 95361 95363 95367 95373 95375 95381 95387 95391 95393 95397 95403 95405 95411 95415 95417 95421 95423 95427 95429 95431 95432 95433 95435 95436 95437 95439 95441 95445 95447 95451 95453 95457 95463 95465 95471 95475 95477 95481 95487 95493 95495 95501 95505 95507 95513 95517 95523 95531 203614
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
设X、Y、Z代表三种元素.已知:
①X+与Y-具有相同的电子层结构;
②Z元素原子核内的质子数比Y元素原子核内的质子数少9个;
③Y与Z两种元素可以形成五核、50个电子的负一价阴离子.
| (1) |
|
X元素名称________,Y元素位于元素周期表的第________列,Z元素在元素周期表中属________族.
|
|
(2) |
|
由X、Y、Z三种元素所形成的含60个电子的盐类化合物的化学式是________
|
|
(3) |
|
元素周期表中第三周期、第一纵行的某元素,能够与Z元素形成既含离子键,又含非极性共价键的化合物,该化合物的电子式为________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
在CaCl2、NaOH、CH4、H2、H2O、H2O2、Na2O2、(NH4)2SO4中
| (1) |
|
只含离子键的是______________________________
|
|
(2) |
|
只含极性键的是______________________________
|
|
(3) |
|
只含非极性键的是______________________________
|
|
(4) |
|
既含有离子键又含有非极性键的是_________________
|
|
(5) |
|
同时含有离子键、共价键和配位键的是____________
|
|
(6) |
|
只以极性键结合的极性分子是____________________
|
|
(7) |
|
既含有极性键又含有非极性键的极性分子是________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
AB2离子化合物的阴、阳离子的电子层结构相同,每摩AB2分子中含有54 mol电子,根据下列反应:
①H2+B2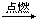 C C
②B2+X Y+AB2+H2O Y+AB2+H2O
③Y+C AB2+Z(Z有漂白作用) AB2+Z(Z有漂白作用)
| (1) |
|
写出下列物质的化学式:AB2________;X________;Y________;Z________
|
|
(2) |
|
用电子式表示AB2的形成过程:________________
|
|
(3) |
|
写出反应②的化学方程式:________________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
有八种晶体:
| (1) |
|
属于原子晶体的化合物是________,直接由原子构成的高熔点的晶体是________,直接由原子构成的分子晶体是________
|
|
(2) |
|
由极性分子构成的晶体是________,含有共价键的离子晶体是________,属于分子晶体的单质是________
|
|
(3) |
|
在一定条件下能导电而不发生化学变化的是________,分子内存在化学键,但受热熔化时,化学键不发生变化的是________,受热熔化时,需克服共价键的是________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
A、B、C、D、E、F、G为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:

其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子极性分子;C与F可形成两个共价型G分子.
| (1) |
|
(2) |
|
比较B与E相应元素的最高价氧化物对应水化物的碱性强弱:________(用化学式表示).
|
|
(3) |
|
D溶于水的电离方程式为________________
|
|
(4) |
|
(5) |
|
C微粒是________F微粒是________用化学式表示).
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大.X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍.
| (1) |
|
请写出元素符号:X________,Y________,Z________,W________
|
|
(2) |
|
X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件)________;E分子的空间构型为________;电子式为________;E在催化剂存在的条件下,可用于还原汽车尾气中的________,以减少对大气的污染.
|
|
(3) |
|
仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子方程式为________
|
|
(4) |
|
这四种元素可组成原子个数比为5∶1∶1∶3的化合物,按X、Y、Z、W的顺序,该化合物的水溶液与足量NaOH溶液反应的离子方程式为________
|
|
(5) |
|
将9 g Y单质在足量W单质中燃烧,所得气体通入1 L 1 mol·L-1的NaOH溶液中.完全吸收后,溶液中的离子浓度由大到小的顺序是________________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
X、Y、Z是主族元素的单质,K、H是化合物,它们有如下反应(式中各物质的化学计量数和反应条件略):
①X+K=H+Y
②X+Z→H
③Y+Z→K
| (1) |
|
若X和Y的组成元素不是同一族,请写出符合①式的三个不同的化学方程式(配平):________,________,________(三个式子中的三种X和三种Y分别由不同族的元素组成).
|
|
(2) |
|
现有某化合物W,它跟化合物K或CO2反应,都能生成单质Y.符合反应化学方程式①、②、③的单质X是________,单质Y是________,单质Z是________,化合物W是________(均写化学式).
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说.
| (1) |
|
根据每个周期最后一种金属元素出现的族序数,预测周期表中原子序数最大的金属元素将在________周期________族(注意:把零族看作ⅧA),周期表在填满________周期后将结束.
|
|
(2) |
|
根据周期表中每个周期非金属元素的种数(把稀有气体看作非金属)预测周期表中应该有________种非金属元素,还有________种未发现,未发现的非金属处在________周期________族.
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
如图所示,已知:
①甲、乙、丙、丁均为前三周期元素的单质.
②在一定条件下甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y,在产物中元素甲呈负价.
③在一定条件下乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价.

请填空:
| (1) |
|
(2) |
|
甲与丙反应生成X的化学方程式是________________________
|
|
(3) |
|
乙与丁反应生成W的化学方程式是______________________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的.人们曾采用乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒就是易燃,于是科学家根据元素性质的递变规律来开发新的致冷剂.
| (1) |
|
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
氢化物的易燃性:第二周期:________>________>H2O、HF
第三周期:SiH4>PH3>________>________
|
|
(2) |
|
化合物的毒性:PH3>NH3 H2S________H2O
CS2________CO2 Cl4>CF4
(选填“>”或“<”=于是科学家们开始把注意力集中在含F、Cl的化合物上.
|
|
(3) |
|
已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间.经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其他类似的还可以是________
|
|
(4) |
|
然而,这种致冷剂造成了当今的某一环境问题是________.但求助于周期表中元素及其化合物的________变化趋势来开发致冷剂的科学思维方法是值得借鉴的.(填写字母,多选扣分)
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
A、①②③
B、②④⑤
C、②③④
|
|
|
查看答案和解析>>
