相关习题
0 95341 95349 95355 95359 95365 95367 95371 95377 95379 95385 95391 95395 95397 95401 95407 95409 95415 95419 95421 95425 95427 95431 95433 95435 95436 95437 95439 95440 95441 95443 95445 95449 95451 95455 95457 95461 95467 95469 95475 95479 95481 95485 95491 95497 95499 95505 95509 95511 95517 95521 95527 95535 203614
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
如图所示是氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图.
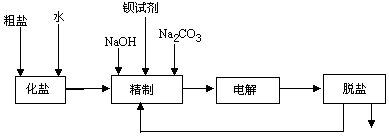
依据工艺流程图,完成下列填空:
| (1) |
|
在电解过程中,与电源负极相连的电极附近,溶液的pH________(填“增大”、“减小”或“不变”).用电极反应式说明溶液中pH发生变化的原因:
_______________________________________
|
|
(2) |
|
在制取NaOH的过程中,需要采用过滤操作的生产阶段是
_______________________________________
|
|
(3) |
|
为有效除去Ca2+、Mg2+、 ,加入试剂的合理顺序是________ ,加入试剂的合理顺序是________
A、先加NaOH,后加Na2CO3,再加钡试剂
B、加NaOH,后加钡试剂,再加Na2CO3
C、先加钡试剂,后加NaOH,再加Na2CO3
D、NaOH、Na2CO3、钡试剂同时加入
|
|
(4) |
|
家庭消毒液的成分是NaClO,用电解法制消毒液的化学方程式是
___________________________________________
|
|
(5) |
|
氯碱厂制取NaOH时,电流强度为b A,电解效率为a.已知NaCl的摩尔质量为58.5 g/mol,NaOH的摩尔质量为40 g/mol,一个电子的电量为QC,阿伏加德罗常数为NA,请用一个代数式表示该氯碱厂生产的NaOH的日产量) (kg):___________________________________________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
从某铝镁合金上剪下一小片(其质量为2.0 g),立即投入盛有20 ml 5 mol·L-1氢氧化钠溶液的小烧杯中.
| (1) |
|
由反应开始到反应结束,可能观察到烧杯中的现象依次为________
|
|
(2) |
|
反应开始时,合金片表面产生气泡较慢,其原因是________;一段时间后反应速率相当快,其原因是________
|
|
(3) |
|
合金片与溶液反应时可能形成的微电池的负极材料是________,正极的电极反应式为________
|
|
(4) |
|
若要利用该反应来测定合金中铝的质量分数,还应测定哪些数据?(如有多种可能,请逐一写出)答:
_______________________________________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
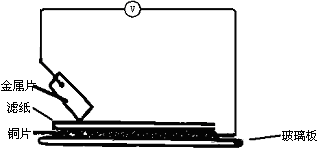

已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据表中数据判断:
| (1) |
|
________金属可能是强的还原剂;________金属一定不能从硫酸铜溶液中置换出铜.
|
|
(2) |
|
若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是________(填字母)金属.其对应的原电池的电极反应式为:负极________;正极________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
用铂电极电解氢氧化钠溶液,测定两极逸出气体的体积,记录如下:

| (1) |
|
完成有关的电极反应式:阴极________;阳极________
|
|
(2) |
|
(3) |
|
开始电解阶段产生气体的体积比不符合理论比值的原因是________
|
|
(4) |
|
自第________min起阴极与阳极产生气体的体积比约为理论的比值.
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
从海水中可提取各种化工原料.如图所示是工业上对海水的几项综合利用的示意图.
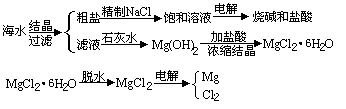
试回答下列问题:
| (1) |
|
粗盐中含有Ca2+、Mg2+、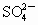 等杂质,精制时所用试剂为
加入试剂的顺序是________(填序号). 等杂质,精制时所用试剂为
加入试剂的顺序是________(填序号). A、盐酸
B、BaCl2溶液
C、NaOH溶液
D、Na2CO3溶液
|
|
(2) |
|
电解饱和食盐水时,与电源正极相连接的电极上发生的反应为________;与电源负极相连的电极附近溶液的pH________(填“变大”、“不变”或“变小”).
|
|
(3) |
|
由MgCl2·6H2O晶体脱水制无水MgCl2时,MgCl2·6H2O晶体在________气氛中加热脱水,该气体的作用是________
|
|
(4) |
|
电解无水MgCl2所得的镁蒸气可以在下列________气体中冷却.
|
| [ ] |
A. |
H2
|
B. |
N2
|
C. |
CO2
|
D. |
O2
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
如图所示①~⑩分别代表有关反应中的一种物质,它们均是中学化学中的常见物质.已知①~⑤和⑥~⑩分别含有同一种元素

| (1) |
|
分别写出①、④、⑧的化学式或离子符号:
_______________________________________
|
|
(2) |
|
写出下列反应方程式,是离子反应的写出离子方程式:
① ⑤ ⑤
① ⑨ ⑨
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
提示:某些金属氧化物跟熔融烧碱反应可生成盐.根据下面流程图如图所示的化学反应框图填空.

| (1) |
|
(2) |
|
写出由E生成G的离子反应方程式(或化学方程式):
_______________________________________
|
|
(3) |
|
溶液I中所含金属离子是:
_______________________________________
|
|
(4) |
|
由G→E+F改为用浓酸,则不能选用的浓酸是(写化学式):
_______________________________________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
室温下,单质A、B、C、分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们以如图所示进行反应.又知E溶液是无色的,请回答:

| (1) |
|
A是________,B是________,C是________,(请填化学式).
|
|
(2) |
|
反应①的化学方程式为:
_______________________________________
|
|
(3) |
|
反应③的化学方程式为:
_______________________________________
|
|
(4) |
|
反应④的化学方程式为:
_______________________________________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
现有电解质溶液:①Na2CO3②NaHCO3 ③NaAlO2 ④CH3COONa⑤NaOH,且已知:CO2+3H2O+2AlO2-=2A1(OH)3↓+
| (1) |
|
当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是________(填编号).
|
|
(2) |
|
将上述物质的量浓度均为0.1 mol/L的五种溶液,稀释相同倍数时,其pH变化最大的是________(填编号).
|
|
(3) |
|
在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是________(填编号).
|
|
(4) |
|
将上述①②③④四种电解质溶液混合,发生反应的离子方程式为________
|
|
|
查看答案和解析>>
科目:
来源:黄冈重点作业 高三化学(下)
题型:022
|
|
已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……
今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①HA+HC2-(少量):A-+H2C-
②H2B(少量)+2A-=B2-+2HA
③H2B(少量)+H2C-=HB-+H3C
回答下列问题:
| (1) |
|
相同条件下,HA、H2B、H3C三种酸中酸性最强的是________
|
|
(2) |
|
A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子的是________,最难结合质子的是________
|
|
(3) |
|
下列反应的离子方程式中正确的是
|
A. |
H3C+3A-=3HA+C3-
|
B. |
HB-+A-=HA+B2-
|
C. |
H3C+B2-=HB-+H2C-
|
|
(4) |
|
完成下列反应的离子方程式:
①H3C+OH-(过量)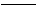 ______________________________ ______________________________
②HA(过量)+C3-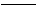 _______________________________ _______________________________
|
|
|
查看答案和解析>>
