相关习题
0 95360 95368 95374 95378 95384 95386 95390 95396 95398 95404 95410 95414 95416 95420 95426 95428 95434 95438 95440 95444 95446 95450 95452 95454 95455 95456 95458 95459 95460 95462 95464 95468 95470 95474 95476 95480 95486 95488 95494 95498 95500 95504 95510 95516 95518 95524 95528 95530 95536 95540 95546 95554 203614
科目:
来源:2007届深圳一重点中学第一轮复习高三化学氮族单元测试(人教) 人教
题型:022
在一包白色粉末,它是由KCL、(NH4)2CO3、(NH4)2SO4、Ca(NO3)2和BaCl2五种化合物中的两种混合而成,今按下列步骤进行实验;
(1)白色粉末和熟石灰一起研磨,可产生有刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝.
(2)另取少量粉末加足量的蒸馏水搅拌,有白色沉淀产生,该沉淀不溶于稀HNO3.
(3)取第二步的滤液中加入AgNO3溶液骨不溶于稀HNO3的白色沉淀生成.
则这包白色粉末是由________和________混合而成,写出有关的化学(或离子)方程式:
第(1)步________
第(2)步________
第(3)步________
查看答案和解析>>
科目:
来源:2007届深圳一重点中学第一轮复习高三化学氮族单元测试(人教) 人教
题型:022
常温下,有一无色混合气体,可能由Cl2、HCl、NO、O2、CO2、N2、H2、NH3中的两种或多种组成,取此混合气体200mL进行实验如下:
(1)将此气体通过浓硫酸体积减少40mL;
(2)剩余气体通过足量过氧化钠固体,体积又减少40mL;
(3)剩余气体仍为无色,引燃后冷却至常温,体积又减少105mL;
(4)最后剩余气体为15mL,经分析知道其中氧气占1/3.则原混合气体中一定不含________,一定含________,其体积分别是________.
查看答案和解析>>
科目:
来源:2007届深圳一重点中学第一轮复习高三化学氮族单元测试(人教) 人教
题型:022
|
|
NO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点.NO亦被称为“明星分子”,试回答下列问题:
| (1) |
|
NO对环境的危害在于________(填以下项目的编号).
|
A. |
破坏臭氧层
|
B. |
高温下能使一些金属被氧化
|
C. |
造成酸雨
|
D. |
与人体血红蛋白结合
|
|
(2) |
|
在含Cu+离子酶活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝根离子在酸性水溶液中反应的离子方程式________.
|
|
(3) |
|
在常温下,将NO气体压缩到1.01×107Pa,在一个体积固定的容器里加热到50℃.发现气体的压强迅速下降,压强降至略小于原压强2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式.________
|
|
(4) |
|
解释(3)中为什么最后的气体总压强小于原压强的2/3?________.
|
|
|
查看答案和解析>>
科目:
来源:2007届汕头澄海华侨中学化学氧化还原单元练习(人教) 人教
题型:022
|
|
已知高温时,C易被O2氧化,C还能与许多氧化物反应;生成CO2或CO、Na、Mg等活泼金属也能将C从其氧化物中还原出来.某同学总结了一张C及其化合物的关系图如下:

问:
| (1) |
|
依上关系图,在反应①中C作________,在反应②中C作________,在反应③中CO2作________;
|
|
(2) |
|
(3) |
|
CaC2俗称电石,是由CaO和焦碳在电炉中高温反应得到,CaC2极易水反应生成电石气——乙炔(C2H2).
①试写出CaC2与水反应的化学方程式,并指出该反应是否是氧化还原反应.
②若某电石厂生产电石时用去含C94.5%的焦炭20t,若炭均完全反应,理论上能生产纯电石多少吨?
③某同学取这种电石4.0g,与水充分反应后,共收集到除去杂质后的纯净电石气(C2H2)1.3g,求这种电石中含CaC2的质量分数是多少?
④试调查一下,这种电石中含有的杂质可能是什么?(供探究学习用)
|
|
|
查看答案和解析>>
科目:
来源:2007届汕头澄海华侨中学化学氧化还原单元练习(人教) 人教
题型:022
|
|
完成下列化学方程式,是氧化还原反应的标出电子转移方向和数目,并指出氧化剂与还原剂.
| (1) |
|
(2) |
|
(3) |
|
(4) |
|
|
查看答案和解析>>
科目:
来源:2007届汕头澄海华侨中学化学氧化还原单元练习(人教) 人教
题型:022
有反应:
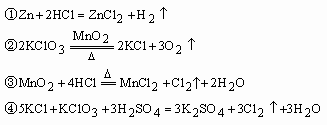
问:在上面四个反应中,反应②中MnO2作________,反应③中MnO2作________,反应①中HCl作________,反应③中HCl作________,反应②中KClO3作________,反应④中KClO3作)________,反应②中KCl是________,反应④中KCl是________.(从“氧化剂、还原剂、酸、催化剂、氧化产物、还原产物”等词中选填)
查看答案和解析>>
科目:
来源:2007届汕头澄海华侨中学化学氧化还原单元练习(人教) 人教
题型:022
|
|
氧是化学反应中的重要元素,按以下要求写出相关反应的化学方程式.
| (1) |
|
(2) |
|
(3) |
|
氧化还原反应中,氧元素既不作氧化剂也不作还原剂________;
|
|
(4) |
|
氧元素既作氧化剂,又作还原剂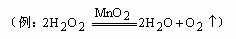 ________;(第4个问供探究学习参考)(以上答案范围较宽,合理均正确) ________;(第4个问供探究学习参考)(以上答案范围较宽,合理均正确)
|
|
|
查看答案和解析>>
科目:
来源:2007届龙台中学高三化学(无机部分)试卷
题型:022
|
|
硫酸工业生产应考虑综合经济效益。
| (1) |
|
工业生产硫酸的原料气成分(体积分数)为:SO27%,O211%,N282%。
压强及温度对SO2转化率的影响如下:
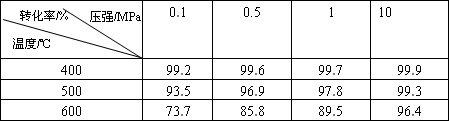
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是________。
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是________。
|
|
(2) |
|
据测算,接触法制硫酸过程中,每生产1t98%的硫酸需消耗3.60×105kJ能量。
若反应:2SO2(g)+O2(g)2SO3(g),ΔH=-196.6kJ/mol放出的热量完全被利用,则每生产1t98%的硫酸可为外界提供________kJ能量(不考虑其他过程释放的能量)。
|
|
(3) |
|
依据题给数据计算:在500℃0.1MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(SO2)∶V(SO3)∶V(O2)∶V(N2)=________∶________∶________∶82(结果保留两位有效数字)。
|
|
|
查看答案和解析>>
科目:
来源:2007届龙台中学高三化学(无机部分)试卷
题型:022
|
|
A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
回答下列问题:
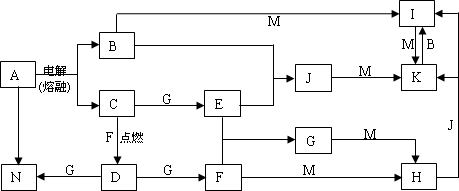
| (1) |
|
H的化学式为________,D的电子式为________。
|
|
(2) |
|
工业上用A制取N的化学反应方程式为________。
|
|
(3) |
|
(4) |
|
I的浓溶液滴入沸水中反应的离子方程式为________。
|
|
(5) |
|
G与M反应的化学方程式为________。在一定条件下该反应也可以向相反的方向进行,请判断该反应与上述转化是否矛盾并说明理由________
|
|
|
查看答案和解析>>
科目:
来源:2007届龙台中学高三化学(无机部分)试卷
题型:022
|
|
化学在能源开发与利用中起着十分关键的作用。
| (1) |
|
蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。
①将“可燃冰”从海底取出,“可燃冰”将融化并放出甲烷气体。请你所学的物质结构知识加以解释:________。
②取356g分子式为CH4·9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成液态水,可放出1780.6kJ的热量,则甲烷的燃烧热为________。
|
|
(2) |
|
设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示)电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。
①已知该电池的负极反应为C4H10+13O2――26e―=4CO2+5H2O,则该电池的正极反应式为________,电池工作时,固体电解质里的O2-向________极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的________(填写物质的名称)堵塞电极的气体通道。
|
|
|
查看答案和解析>>