相关习题
0 95371 95379 95385 95389 95395 95397 95401 95407 95409 95415 95421 95425 95427 95431 95437 95439 95445 95449 95451 95455 95457 95461 95463 95465 95466 95467 95469 95470 95471 95473 95475 95479 95481 95485 95487 95491 95497 95499 95505 95509 95511 95515 95521 95527 95529 95535 95539 95541 95547 95551 95557 95565 203614
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(3) 人教 人教
题型:022
|
|
t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白: xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
| (1) |
|
(2) |
|
比较达到平衡时,A、B两反应物的转化率之比为α(A)∶α(B)=________;
|
|
(3) |
|
若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是________(填写字母序号)
|
A. |
化学平衡向正反应方向移动
|
B. |
化学平衡向逆反应方向移动
|
C. |
化学平衡不会发生移动
|
D. |
正、逆反应的化学反应速率保持不变
|
|
(4) |
|
在t℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入________(填A或B)________mol(用a表示).
|
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(3) 人教 人教
题型:022
|
|
科学家从化肥厂生产的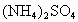 中检出组成为 中检出组成为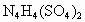 的物质,经测定,该物质易溶于水,在水中以 的物质,经测定,该物质易溶于水,在水中以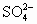 和 和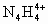 两种离子形式存在,植物的根系极易吸收 两种离子形式存在,植物的根系极易吸收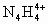 ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收. ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收.
请回答下列问题:
| (1) |
|
N4和N2的关系正确的是________(填序号)
|
| [ ] |
A. |
同种单质
|
B. |
同位素
|
C. |
同分异构体
|
D. |
同素异形体
|
|
(2) |
|
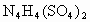 ________(填“能”或“不能”)和草木灰混合施用: ________(填“能”或“不能”)和草木灰混合施用:
|
|
(3) |
|
(4) |
|
已知液氨中存在着平衡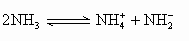 .科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的 .科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的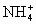 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:________; 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:________;
|
|
(5) |
|
含有一定量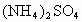 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明. 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明.
加酸时: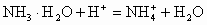
加碱时: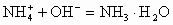
由于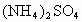 和 和 的大量存在,加少量酸或碱时,溶液中C(H+)与C(OH—)基本保持不变; 的大量存在,加少量酸或碱时,溶液中C(H+)与C(OH—)基本保持不变;
含有一定量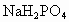 和 和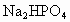 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式: 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时________;
加碱时________.
|
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(3) 人教 人教
题型:022
|
(1) |
|
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)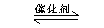 2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题: 2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
|
|
(2) |
|
若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”).
|
|
(3) |
|
若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量________2.1mol(填“<”、“>”或“=”),并简单说明原因________
|
|
(4) |
|
若其它条件不变,在t1时再加入0.2molSO3、0.1molO2和1.8molSO3,在图中作A从t0→t1→t2点这段时间内SO2的物质的量变化曲线.
|
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(3) 人教 人教
题型:022
|
|
用电弧法合成的储氢纳米碳管常伴有大量的碳纳米顺粒(杂质),这种颗粒可用氧化气化法提纯,其反应式为:
| (1) |
|
(2) |
|
此反应的氧化剂是________,氧化产物的电子式________:
|
|
(3) |
|
H2SO4在上述反应中表现出来的性质是________(填选项编号)(多选倒扣分)
|
| [ ] |
A. |
酸性
|
B. |
氧化性
|
C. |
吸水性
|
D. |
脱水性
|
|
(4) |
|
上述反应中若产生0.2molCO2气体,则转移电子的物质的量是________mol.
|
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(3) 人教 人教
题型:022
|
|
硼酸晶体呈片状,有滑腻感,可作润滑剂,硼酸对人体的受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面.试回答下列问题:
| (1) |
|
从题目信息可知硼酸应属于________酸(弱、强、中强)
|
|
(2) |
|
硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为:________.
|
|
(3) |
|
研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层具有达到8电子稳定结构的趋向.已知0.01mol硼酸可以被20mL0.5mol·L-1NaOH溶液恰好完全中和,据此推测硼酸在水溶液中酸性的原因是(用离子方程式表示)________
写出硼酸与NaOH溶液反应的化学方程式:________
|
|
(4) |
|
硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式:________
|
|
(5) |
|
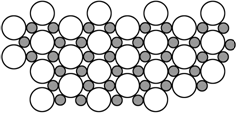
科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据右图确定硼化镁的化学式为________
|
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(3) 人教 人教
题型:022
|
|
1932年,美国化学大师LinusPauling提出电负性(用希腊字母χ表示)的概念,
用来确定化合物中原子某种能力的相对大小.LinusPauling假定F的电负性为4,并通过
热化学方法建立了其他元素的电负性.LinusPauling建立的主族元素的电负性如下:
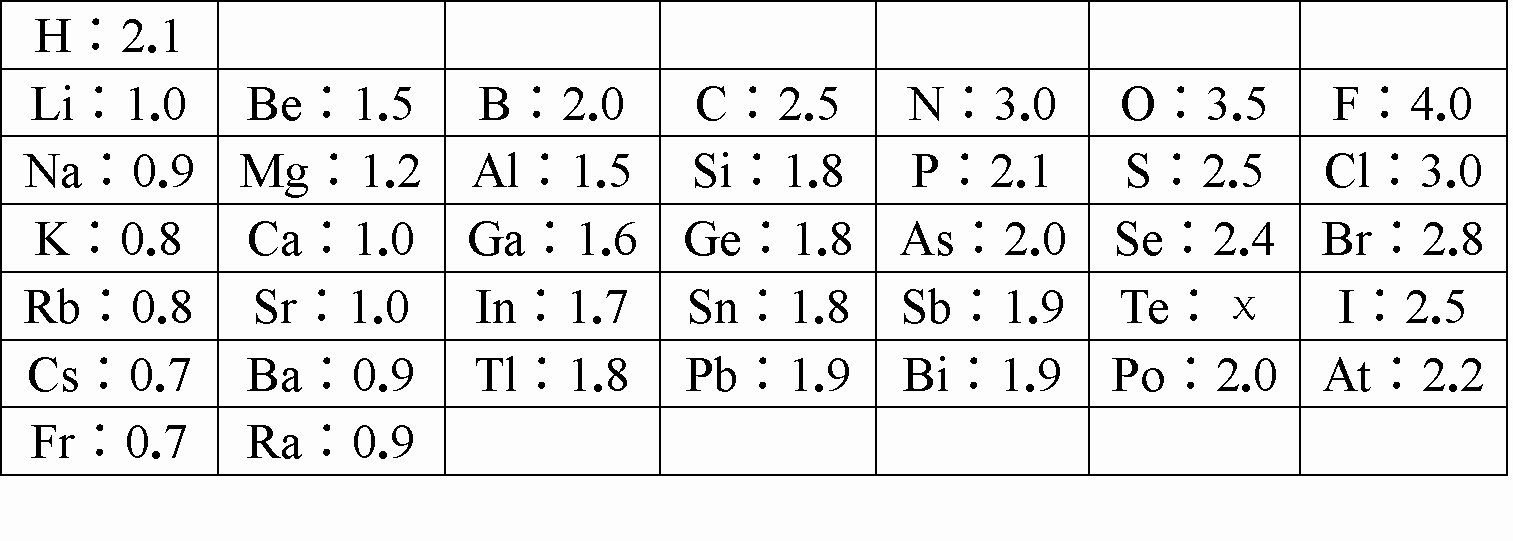
回答下列问题:
| (1) |
|
(2) |
|
大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物.用电子式表示AlBr3的形成过程________.
|
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(3) 人教 人教
题型:022
下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是________

查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(2) 人教 人教
题型:022
|
|
有A、B、C、D、E、F六瓶未知溶液.它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH.为了鉴别,各取少许溶液进行两两混和试验,结果如右表.表中"↓"表示有沉淀或生成微溶化合物,"↑"表示有气体生成,"—"表示观察不到明显的现象变化.
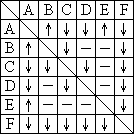
| (1) |
|
请写出下列物质的化学式:C________、D________、E________、F________.
|
|
(2) |
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(2) 人教 人教
题型:022
|
|
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分).
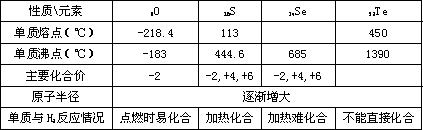
请根据上表回答下列问题:
| (1) |
|
(2) |
|
(3) |
|
硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是________(填化学式).
|
|
(4) |
|
氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为________.
|
|
(5) |
|
工业上Al2Te3可用来制备H2Te,完成下列化学方(△E)
程式:A12Te3+( )A1(OH)3↓+H2Te↑
|
|
(6) |
|
右图所示为氧族元素单质与H2反应过程中的能
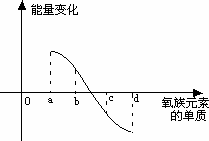
量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应).则:b代表________,d代表________(均写单质名称).
|
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(2) 人教 人教
题型:022
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料.加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解.mmol高氯酸铵分解时除产生2mmol水蒸气和mmol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力.
写出其中涉及到的化学方程式:
________;
________.
(2)高氯酸铵作为火箭燃料的重要氧载体.高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气.
①写出此反应的化学方程式________.
②反应中生成的氧化产物与还原产物的物质的量之比是________,
每分解1mol高氯酸铵,转移的电子数目是________.
查看答案和解析>>

