
科目: 来源:江苏省苏州中学2006-2007学年度高三化学初考试卷 题型:022
化学实验必须注意安全,下列做法存在安全隐患的是________(选填序号)
A、氢气还原氧化铜实验中,先加热氧化铜后通氢气
B、蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
C、实验室做钠的实验时,余下的钠屑投入到废液缸中
D、配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E、皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F、制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
查看答案和解析>>
科目: 来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷 题型:022
⑴常温下取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)________0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合物中下列算式的精确计算结果(填具体数字):c(Cl-)—c(M+)=________mol/L,c(H+)—c(MOH)=________mol/L.
⑵如果常温下取0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的PH<7,则说明MOH的电离程度________MCl的水解程度.(填“>”、“<”、或“=”)
(3)弱酸的相对强弱可以用电离常数(K)表示.以HF为例,其电离常数的计算方法是:K=![]() [c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度].同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样.资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11.回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=________,c(OH-)=________.
[c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度].同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样.资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11.回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=________,c(OH-)=________.
查看答案和解析>>
科目: 来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷 题型:022
(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:
2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度.回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度.回答下列问题:
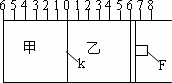
(1)可根据________现象来判断甲、乙都已达到平衡.
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是________.
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为________mol,乙中C的转化率________50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度________处(填下列序号)①<6②>6③=6.
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于________;若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于________.
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)甲、乙中C的物质的量是________(填:“甲>乙”或“甲<乙”或“甲=乙”);
(2)测得甲中A的转化率为b,则乙中C的转化率为________;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是________.
查看答案和解析>>
科目: 来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷 题型:022
| |||||||||||||||
查看答案和解析>>
科目: 来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷 题型:022
| |||||||||||||||
查看答案和解析>>
科目: 来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷 题型:022
(Ⅰ)据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构.
(1)下列有关O4的说法正确的是________
A、O4分子内存在极性共价键B、合成O4的反应可看作核聚变反应,即不属于化学变化
C、O4与O3、O2都是氧的同素异形体D、O4将来可用作更强有力的火箭推进的氧化剂
(2)含O2-、O22-甚至O2+的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:该反应中________(填序号)相当于氧分子的还原.

(3)化合物O2[PtF6]中含有O![]() ,有一种常见的含有O
,有一种常见的含有O![]() 的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:________
的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:________
(Ⅱ)《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13∶1,NO3-的比例呈明显上升的趋势.
回答下列问题:
⑴江苏省大气污染特征是________
A、煤烟型B、机动车尾气型C、由煤烟型向煤烟型与机动车尾气混合型转化
D、由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵某研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究.
①如果你参加该课题的探究,在讨论测定地点时,你建议选择的地点分别是________.
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫.变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是________.
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
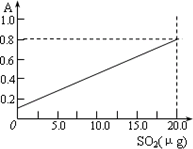
HCHO+H2SO3→![]()
该反应类型属于________.测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量.实验测得SO2含量与溶液的吸光度A的关系如右上图所示.若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为________.
查看答案和解析>>
科目: 来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷 题型:022
(1)下列有关实验操作或判断不正确的是________(填有关序号,选错倒扣分).
A、用10mL量筒量取稀硫酸溶液8.0mL
B、用干燥的pH试纸测定氯水的pH
C、用碱式滴定管量取KMnO4溶液19.60mL
D、使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E、圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
F、测定硫酸铜晶体中结晶水含量时,将加热后的坩埚置于干燥器中冷却后再称量
G.用冰醋酸,蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
(2)实验室利用如右图装置进行中和热的测定.

回答下列问题:
①该图中有两处未画出,它们是________、________;
②如果用0.5mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将(填“偏大”、“偏小”或“不变”);原因是________.
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
2MnO4-+5C2O42-+16H+![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
①用托盘天平称取WgNa2C2O4晶体.
②将WgNa2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中.
③若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的量浓度为________(填表达式).
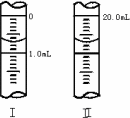
④若滴定完毕立即读数,测定的KMnO4溶液的浓度________(填“偏高”“偏低”或“不变”).
查看答案和解析>>
科目: 来源:江苏省江浦高级中学2006-2007学年高三年级第二次月考、化学试卷 题型:022
实验测得某烃中碳元素的质量分数为91.3%,相对分子质量为92,则该烃的分子式为________.若该烃为芳香烃,在其分子的“C-C”键或“H-C”键中插入基团“![]() ”可形成六种含苯环的酯,请写出其中四种酯的结构简式:________、________、________、________.
”可形成六种含苯环的酯,请写出其中四种酯的结构简式:________、________、________、________.
查看答案和解析>>
科目: 来源:江苏省江浦高级中学2006-2007学年高三年级第二次月考、化学试卷 题型:022
| |||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com