相关习题
0 95407 95415 95421 95425 95431 95433 95437 95443 95445 95451 95457 95461 95463 95467 95473 95475 95481 95485 95487 95491 95493 95497 95499 95501 95502 95503 95505 95506 95507 95509 95511 95515 95517 95521 95523 95527 95533 95535 95541 95545 95547 95551 95557 95563 95565 95571 95575 95577 95583 95587 95593 95601 203614
科目:
来源:山东省蓬莱、牟平2006-2007学年度第一学期高三年级期中考试、化学试题
题型:022
|
|
水是自然界中最重要的物质之一
| (1) |
|
冰的熔点在101.325Kpa下是273K,其熔化热△H=6.0kJ·mol-1,则1molH2O在273K、101.325KPa下熔化时的熵变△S=________.
|
|
(2) |
|
已知:298K、101.325KPa下,
2H2(g)+O2(g) 2H2O(l),△H-T△S=-237.9kJ·mol-1, 2H2O(l),△H-T△S=-237.9kJ·mol-1,
①由上述信息可知,反应2H2(g)+O2(g) 2H2O(l),在298K、101.325KPa下能自发进行,可实际该反应很难发生,原因是________. 2H2O(l),在298K、101.325KPa下能自发进行,可实际该反应很难发生,原因是________.
②以多孔镍电极插入KOH溶液中,然后分别向两电极上通H2和O2,可验成氢氧燃料电池,该电池中,OH-移向________(填“正”、“负”)极,正极上的电极反应________.
|
|
(3) |
|
已知298K时,BaCO3、BaSO4的KSP分别为5.1×10-9mol2·L-2、1.1×10-10mol2·L-2,现将0.1molBaCO3和0.1molNa2SO4投入水中,充分搅拌,则反应BaCO3(s)+Na2SO4(ag)=Na2CO3(ag)+BaSO4(s)的△H-T△S________0(填“>”“=”“<”)
|
|
|
查看答案和解析>>
科目:
来源:山东省蓬莱、牟平2006-2007学年度第一学期高三年级期中考试、化学试题
题型:022
|
|
已知A为中学化学中的常见金属,X、Y为常见非金属,A、X、Y都位于周期表中短周期.其中A、Y常温下为固体,X、E、F、G、J常温下为气体,C为无色液体,B是一种盐,受热易分解,分解产物为E和HCl.现用A与石墨作电极,B的浓溶液作电解质,构成原电池.有关物质之间的转化关系如下图(部分反应的条件、生成物被略去):
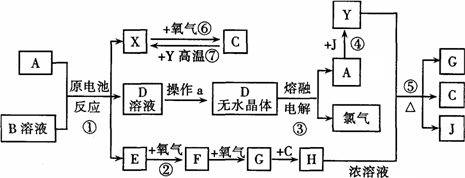
请填定下列空白:
| (1) |
|
金属A为________;操作a是将D溶液在HCl气流中蒸干,原因是________.
|
|
(2) |
|
反应②的化学方程式为:________;
反应⑤的化学方程式为:________.
|
|
(3) |
|
|
查看答案和解析>>
科目:
来源:山东省蓬莱、牟平2006-2007学年度第一学期高三年级期中考试、化学试题
题型:022
|
|
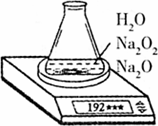
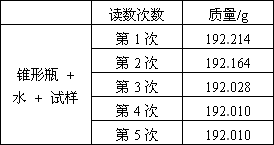
某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用图示装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如附表:
| (1) |
|
计算过氧化钠的质量分数时,必需的数据是________;不必作第6次读数的原因是________.
|
|
(2) |
|
测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
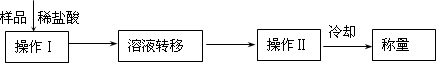
①操作Ⅱ的名称是________.
②需要直接测定的物理量是________.
③测定过程中需要的仪器有电子秤、蒸发皿、酒精灯,还需要________、________(固定、平持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果________(填偏大、偏小或不变).
|
|
|
查看答案和解析>>
科目:
来源:山东省聊城市2006-2007学年度第一学期高三年级期中考试、化学试题
题型:022
|
|
400K、101.3kPa时,L1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(同温同压下测定).
| (1) |
|
(2) |
|
当a=10L时,该烃可能的分子式为________
|
|
(3) |
|
当该烃的人子式为C7H8时,a的取值范围为________.
|
|
|
查看答案和解析>>
科目:
来源:山东省聊城市2006-2007学年度第一学期高三年级期中考试、化学试题
题型:022
下列各单质(A、B、C)和化合物(甲、乙、丙、丁)
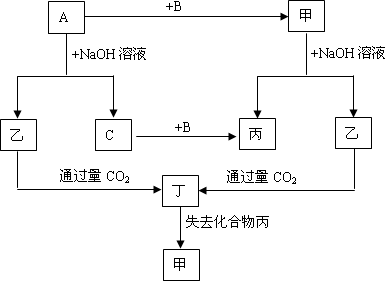
之间有以下的转化关系,而且各单质和化合物的组成元素皆为短周期元素.
试推断各化合物的化学式为:
甲________、乙________、丙________、丁________.
查看答案和解析>>
科目:
来源:山东省聊城市2006-2007学年度第一学期高三年级期中考试、化学试题
题型:022
|
|
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4倍.A、B、D、E这四种元素,每种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
| (1) |
|
写出B、C、D、E元素的元素符号:B________C________D________E________
|
|
(2) |
|
A、B、C、E四种元素可形成两种酸式盐,这两种酸式盐的化不式为________、________;这两种酸式盐在溶液中相互反应的离子方程式为________
|
|
(3) |
|
由A、C、D三种元素形成化合物的电子式为________,其中含有的化学键为________
|
|
(4) |
|
用电子式表示化合物A2E的形成过程________
|
|
|
查看答案和解析>>
科目:
来源:山东省济南市2006-2007学年度第一学期高三年级统一考试、化学试题
题型:022
|
|
使一定量的H2在Cl2中充分燃烧,将反应后的气体缓慢通入100ml1.0mol·L-1的NaOH溶液中.下图甲表示某种离子的物质的量(n)随通入气体体积(V)的变化曲线;图乙表示溶液的导电性随通入气体体积(V)的变化曲线.

请回答下列问题:
| (1) |
|
图甲表示溶液中________离子的变化曲线.(填写下列各项的序号)
①H+ ②Na+ ③Cl ④ClO-
|
|
(2) |
|
图乙中,当通入的气体体积大于V2时,引起溶液导电性明显增强的主要阴、阳离子是________和________(填写离子符号).
|
|
(3) |
|
设n=0.01mol,试确定点燃前H2和Cl2的物质的量之比(写出计算过程).
|
|
|
查看答案和解析>>
科目:
来源:山东省济南市2006-2007学年度第一学期高三年级统一考试、化学试题
题型:022
|
|
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
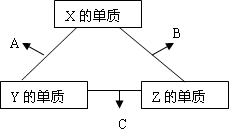
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.
请回答下列问题:
| (1) |
|
(2) |
|
X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入________(填物质名称);负极电极反应式为________.
|
|
(3) |
|
C在一定条件下反应生成A的化学方程式是________.
|
|
(4) |
|
X、Y、Z三种元素可组成一种强酸,W,C在适当条件下被W溶液吸收生成一种盐.该盐的水溶液Ph________7(填“大于”、“小于”或“等于”)其原因是(用离子方程式表示):________.
|
|
(5) |
|
已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温,恒压条件下反应.下列说法中,正确的是________.(填写下列各项的序号)
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
|
|
|
查看答案和解析>>
科目:
来源:山东省济南市2006-2007学年度第一学期高三年级统一考试、化学试题
题型:022
|
|
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
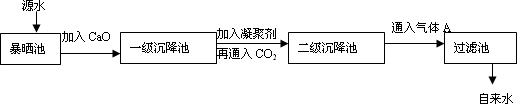
| (1) |
|
源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干复分解反应,试写出其中的一个离子方程式________.
|
|
(2) |
|
加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是________.(填写下列各项的序号)
①只有物理过程,无化学过程 ②只有化学过程,无物理过程 ③既有化学过程又有物理过程
FeSO4·7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状沉淀是________.
|
|
(3) |
|
通入二氧化碳的目的是________和________.
|
|
(4) |
|
(5) |
|
下列物质中,________可以作为气体A的代替品.(填写下列各项的序号)
①ClO2 ②浓氨水 ③SO2 ④浓硫酸
|
|
|
查看答案和解析>>
科目:
来源:山东省济南市2006-2007学年度第一学期高三年级统一考试、化学试题
题型:022
|
|
某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质.查得资料如下:
①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te
③氧气、硫、硒、碲与1molH2反应的焓变情况如下表所示.
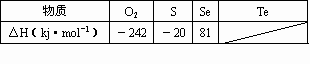
请回答下列问题:
| (1) |
|
写出氧族元素中含有的18个电子的两种氢化物的化学式________、________.
|
|
(2) |
|
写出硒化氢发生反应的热化学方程式:________.
|
|
(3) |
|
已知298K时,H2Te分解反应的△S>0,△H=-154kj·mol-1,请解释Te和H2不能直接化合的原因________.
|
|
(4) |
|
H2S的水溶液显弱酸性,写出其电离方程式________;它的第一级电离常数可用Kal来表示,当温度升高时,Kal的值________(填“一定增大”、“一定减小”或“不能确定”).
|
|
(5) |
|
一定温度下,在容积均为1L(容器容积不可变)的甲、乙两个容器中,分别充入2molSO2、1molO2和4molSO2、2molO2,在相同条件下使其反应.最终达到平衡后,甲、乙两容器中SO2转化率分别为50%和a(乙),则该温度下,反应的平衡常数Kc=________L·mol-1(填写具体数据),此时a(乙)________50%(填“大于”“小于”或“等于”).
|
|
|
查看答案和解析>>

