相关习题
0 95413 95421 95427 95431 95437 95439 95443 95449 95451 95457 95463 95467 95469 95473 95479 95481 95487 95491 95493 95497 95499 95503 95505 95507 95508 95509 95511 95512 95513 95515 95517 95521 95523 95527 95529 95533 95539 95541 95547 95551 95553 95557 95563 95569 95571 95577 95581 95583 95589 95593 95599 95607 203614
科目:
来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷
题型:022
|
|
元素周期表是20世纪科学技术发展的重要理论依据之一.
已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在课本元素周期表中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
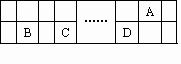
根据以上信息,回答下列问题:
| (1) |
|
元素C在元素周期表中的位置是________周期________族.
|
|
(2) |
|
A和D的氢化物中,沸点较低的是________(填“A”或“D”);A和B的离子中,半径较小的是________(填离子符号).
|
|
(3) |
|
A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心.该化合物的电子式为________.
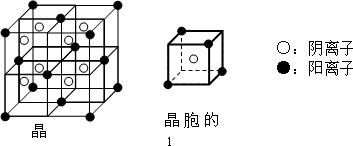
|
|
|
查看答案和解析>>
科目:
来源:天佑中学2007届高考复习单元过关《碱金属、物质的量》试卷、化学
题型:022
|
|
某无色溶液中可能含有Na+、SO42—、SO32—、CO32—、Cl—、Cu2+、Ba2+、Br—等几种离子中的若干种,依次进行下列实验,观察到的现象如下:
①用PH试纸检验,溶液的PH大于7;②向溶液中滴加氯水无气体产生,再加入CCl4振荡,静止,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,只有白色沉淀生成,过滤;④在滤液中加入AgNO3和HNO3的混合溶液,有白色沉淀产生.
| (1) |
|
原溶液中肯定有的离子是________;肯定没有的离子是________;
|
|
(2) |
|
若步骤③改用BaCl2和盐酸的混合溶液,对判断⑴结论有无影响?________(填“有或无”);
|
|
(3) |
|
写出步骤②发生的有关反应的离子方程式:________
|
|
|
查看答案和解析>>
科目:
来源:天佑中学2007届高考复习单元过关《碱金属、物质的量》试卷、化学
题型:022
|
|
工业上生产4J29合金(铁、钴、镍合金)废物中提取钴和镍,一般是用H2SO4溶解合金使其成为Fe2+、Co2+和Ni2+,再将Fe2+氧化成Fe3+,从而使Fe3+转化为某种沉淀析出,从而达到与Co2+和Ni2+分离的目的,生产上要实现上述氧化过程,可采用加入NaClO或NaClO3溶液(均含有少量的H2SO4).
阅读材料:生产上除去溶液中Fe3+的一般方法是:控制溶液的pH=1.6~1.8,温度在85℃~95℃时,使Fe3+在热的溶液中发生水解,最终生成沉淀除去.
| (1) |
|
上述反应可用以下化学反应式表示:
NaClO+FeSO4+H2SO4NaCl+Fe2(SO4)3+H2O
NaClO3+FeSO4+H2SO4NaCl+Fe2(SO4)3+H2O(均未配平)
请问:若从化学反应的反应物计量关系上看,应选择何种氧化剂?并说明理由:________
|
|
(2) |
|
通过阅读材料,若利用离子水解使Fe3+与Co2+和Ni2+分离还需要知道什么信息?________
|
|
(3) |
|
配平下列离子方程式,并回答下列有关问题:
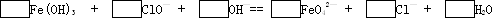
若已知有3.21gFe(OH)3参加反应,则电子转移了________个.
|
|
|
查看答案和解析>>
科目:
来源:天佑中学2007届高考复习单元过关《碱金属、物质的量》试卷、化学
题型:022
|
|
有一不含结晶水的固体物质的溶液甲,在一定温度下,经历如下变化:溶液甲蒸发10g水,未见晶体析出得溶液乙;再蒸发10g水,析出3g晶体,并得溶液丙.试回答下列问题:
| (1) |
|
该温度下,甲、乙、丙三种溶液中一定是饱和溶液的是________.
|
|
(2) |
|
若乙为饱和溶液,则该温度下固体物质的溶解度为________.
|
|
|
查看答案和解析>>
科目:
来源:天佑中学2007届高考复习单元过关《碱金属、物质的量》试卷、化学
题型:022
|
|
某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20mL蒸馏水③以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,需用去VxmL达滴定终点④加入25mL0.1mol·L-1的HCl溶液
| (1) |
|
写出全部实验过程的步骤________.(写编号顺序)
|
|
(2) |
|
如图所示的仪器中配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液肯定不需要的仪器是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称).

|
|
(3) |
|
配制上述溶液应选用的容量瓶规格分别为________(填字母).
|
| [ ] |
A. |
50mL,50mL
|
B. |
100mL,100mL
|
C. |
100mL,150mL
|
D. |
250mL,250mL
|
|
(4) |
|
写出相关的化学反应方程式:________,________.
|
|
(5) |
|
胃药中含碳酸钙的质量为:________g(写出计算式并加以文字说明).
|
|
|
查看答案和解析>>
科目:
来源:宿迁市2007届高三第一次教学调查情况考试、化学
题型:022
|
|
水是极弱的电解质其可以发生微弱的电离,纯水的电离平衡曲线如图所示:

| (1) |
|
曲线A和B对应的温度不同,其中温度高的为________,在B点的纯水的PH=________呈________性
|
|
(2) |
|
曲线A对应温度下,1mol/LNaB溶液的pH=9,则该溶液中各离子的物质的量浓度由大到小的顺序为________.
|
|
(3) |
|
曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,结合必要的化学用语解释pH=5的原因:________.
|
|
(4) |
|
曲线B对应温度下,若1体积的某强酸和10体积的某强碱混合后溶液显中性,则混合前强酸的pH(pH酸)和强碱的pH(pH碱)的关系为________.
|
|
|
查看答案和解析>>
科目:
来源:宿迁市2007届高三第一次教学调查情况考试、化学
题型:022
|
|
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、Na+、NH4+、CO32-、NO3-、OH-、SO42-将这4种溶液分别标记为A、B、C、D进行如下实验:
①在A或D中滴入C,均有沉淀生成
②A和B反应生成的气体能被D吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
| (1) |
|
A的化学式是________,判断的理由是________
|
|
(2) |
|
写出其余几种物质的化学式:B________C________D________
|
|
(3) |
|
写出实验②中有关反应的离子方程式________.
|
|
|
查看答案和解析>>
科目:
来源:宿迁市2007届高三第一次教学调查情况考试、化学
题型:022
|
|
我们知道自然界中的蜘蛛丝和细菌纤维素纤维是典型的纳米纤维.较细的蜘蛛丝直径还不足100纳米,是真正的天然纳米纤维.美国与加拿大的科学家合作,采用蜘蛛基因,利用仿生结构,成功地纺制出人造蜘蛛丝,其强韧性能优于钢材.
| (1) |
|
纳米纺织材料凭借其内部所特有的小尺寸效应、表面效应等日益受到广大消费者的
喜爱.许多纳米材料的粒子直径都在1~100nm之间,从分散系的角度看应该属于________
|
|
(2) |
|
纳米是长度单位,物质的颗粒达到纳米级时,具有不同的性质,如果单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,下列对“纳米铜”的说法正确的是:________(填序号)
A、“纳米铜”与铜片还原性相同
B、“纳米铜”比铜片更易失电子
C、“纳米铜”比铜片的氧化性强
|
|
(3) |
|
钢铁在人们生活中应用非常广泛,但是钢铁因腐蚀造成的损失全球每年高达7000亿美元,目前钢铁被腐蚀的主要形式是吸氧腐蚀,其正极发生________反应,负极发生的电极反应式为________.为了减少这种腐蚀生产生活中常见的有哪些防腐措施:________.(至少填两种措施)
|
|
|
查看答案和解析>>
科目:
来源:宿迁市2007届高三第一次教学调查情况考试、化学
题型:022
|
|
已知A为常见金属,在空气中燃烧发出耀眼的白光,X、Y为常见非金属,X、E、F、G常温常压下为气体,C为液体,B是一种盐,受热易分解,在工农业生产中用途较广(如被用作某些电池的电解质).现在A与石墨作电极,B的浓溶液作电解质溶液,构成原电池.
请填写下列空白:
| (1) |
|
反应④为在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为________
|
|
(2) |
|
(3) |
|
从D溶液制备D的无水晶体的“操作a”为________
|
|
(4) |
|
工业上常利用电解熔融D的无水晶体来制取A,而不用电解熔融A的氧化物来制取A,简述理由________
|
|
(5) |
|
为了较准确测定G气体的相对分子质量,对测定条件有何要求________
|
|
|
查看答案和解析>>
科目:
来源:宿迁市2007届高三第一次教学调查情况考试、化学
题型:022
|
|
已知A、B、C、D均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,C原子的最外层电子数是次外层的3倍;C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物.A、B、C三种元素可以形成离子晶体,该晶体可以和氢氧化钠反应放出无色刺激性气味气体E.请回答下列问题:
| (1) |
|
写出B单质的电子式________;C和D形成淡黄色固体化合物电子式________.
|
|
(2) |
|
元素原子的物质的量之比为A:B:C=4:2:3的晶体名称为________其水溶液显________性,用离子方程式说明________.
|
|
(3) |
|
E分子的空间构型是________,属于________分子(填极性或非极性)
|
|
(4) |
|
A、B、C三种元素还可以形成另一种化合物,其热的浓溶液可以溶解铝和铁,但常情况下它的浓溶液又可盛放在铝或铁制的容器中,原因是________.
|
|
|
查看答案和解析>>
