相关习题
0 95414 95422 95428 95432 95438 95440 95444 95450 95452 95458 95464 95468 95470 95474 95480 95482 95488 95492 95494 95498 95500 95504 95506 95508 95509 95510 95512 95513 95514 95516 95518 95522 95524 95528 95530 95534 95540 95542 95548 95552 95554 95558 95564 95570 95572 95578 95582 95584 95590 95594 95600 95608 203614
科目:
来源:新星高级中学2006-2007学年高三统一考试、化学专业试卷(一)(人教) 人教
题型:022
对于司机酒后驾车,可对其呼出的气体进行检验而查出,所利用的化学反应如下:2CrO3(红色)+3C2H5OH+3H2SO4===Cr2(SO4)3(绿色)+3CH3CHO+6H2O.被检测的气体成分是________,上述反应中的氧化剂是________,还原剂是________
查看答案和解析>>
科目:
来源:新星高级中学2006-2007学年高三统一考试、化学专业试卷(一)(人教) 人教
题型:022
|
|
我国规定饮用水质量标准必须符合下列要求:

以下是原水处理成自来水的工艺流程示意图
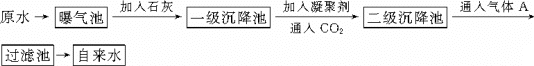
| (1) |
|
水中含Ca2+、Mg2+、HCO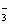 、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式________ 、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式________
|
|
(2) |
|
凝聚剂除去悬浮固体颗粒的过程________(填写编号,多选倒扣)
①只是物理过程 ②只是化学过程 ③是物理和化学过程FeSO4·7H2O是常用的凝聚剂,它在水中最终生成________沉淀.
|
|
(3) |
|
通入二氧化碳的目的是________和________.
|
|
(4) |
|
气体A的作用是________.这种作用是基于气体A和水反应的产物具有________性.
|
|
(5) |
|
下列物质中,________可以作为气体A的代用品.(填写编号,多选倒扣)
①Ca(ClO)2 ②浓氨水 ③K2FeO4 ④SO2
|
|
|
查看答案和解析>>
科目:
来源:厦门双十中学2007届高三年级上学期半期考、化学试题
题型:022
|
|
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
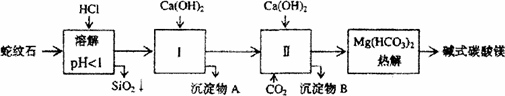
| (1) |
|
蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________
|
|
(2) |
|
进行I操作时,控制溶液pH=7—8(有关氢氧化物沉淀的pH见右表)

Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀.
|
|
(3) |
|
从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入________(填入物质的化学式),然后________(依次填写实验操作名称).
|
|
(4) |
|
物质循环使用,能节约资源.上述实验中,可以循环使用的物质是________(填写物质化学式).
|
|
(5) |
|
现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量②高温分解③________或________④MgO称量
|
|
(6) |
|
18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中:
a=________b=________C=________
|
|
|
查看答案和解析>>
科目:
来源:厦门双十中学2007届高三年级上学期半期考、化学试题
题型:022
|
|
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如下(图中部分产
物未列出):请填写下列空白:
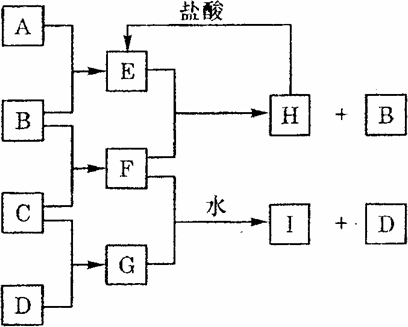
| (1) |
|
(2) |
|
H与盐酸反应生成E的化学方程式是________.
|
|
(3) |
|
(4) |
|
F与G的水溶液反应生成I和D的离子方程式是________.
|
|
|
查看答案和解析>>
科目:
来源:厦门双十中学2007届高三年级上学期半期考、化学试题
题型:022
|
|
某研究小组进行与NH3有关的系列实验.
| (1) |
|
从下图中挑选所需仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管.固定装置和尾气处理装置不用画),并标明所用试剂.________.
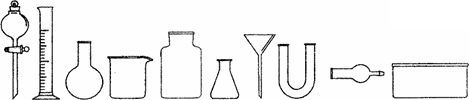
|
|
(2) |
|
将NH3通入溴水中,有N2生成,反应的化学方程式为________.
|
|
(3) |
|
为验证“同温同压下,相同体积的任何气体都含有相同数目的分子”,该小组同学设计了如下图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略;HCl和NH3均不溶于石蜡油,也不与之反应;装置气密性好).
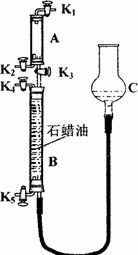
①在A管中充满与大气压强相等的干燥HCl气体.操作是________.控制活塞K4、K5,调节C,使B管充满与A管同压的干燥NH3.
②缓缓开启K3,A管中的现象是________.要达到实验目的,当反应完成并恢复到室温时,B管中预期的现象是________.
|
|
|
查看答案和解析>>
科目:
来源:厦门双十中学2007届高三年级上学期半期考、化学试题
题型:022
|
|
次磷酸(H3PO2)是一种强还原性弱酸,它能发生下列反应:
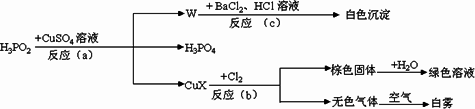
| (1) |
|
CuX中X是表示一种元素,这种元素是________.
|
|
(2) |
|
反应(a)的化学方程式为________,其中被氧化的元素是________,还原产物是________(写物质的名称).
|
|
(3) |
|
(4) |
|
反应(b)中,当有1molCuX被氧化时,转移的电子数目为________个.
|
|
|
查看答案和解析>>
科目:
来源:厦门双十中学2007届高三年级上学期半期考、化学试题
题型:022
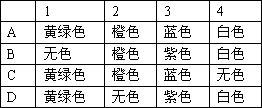
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是________

查看答案和解析>>
科目:
来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷
题型:022
|
|
如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器.在相同温度下,分别将1molN2和3molH2混合气体充入A、B容器中,发生如下反应:

N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol. 2NH3(g);△H=-92.4kJ/mol.
保持温度不变,A、B容器中的反应均达到平衡状态.平衡时,A容器中气体体积为起始时的4/5,平衡状态记为P.
试回答下列问题:
| (1) |
|
平衡时A容器中NH3的体积分数是________.若要使B容器中NH3的体积分数与A容器中相同,可采取的措施是________.
|
|
(2) |
|
若保持温度不变,向B容器中补加cmolNH3,再次达到平衡时,A、B两容器中压强恰好相等,则c=________.
|
|
(3) |
|
若保持温度不变,开始时向容器A中加入amolN2、bmolH2和cmolNH3,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原A平衡状态P相同,则起始时,c的取值范围是________.
|
|
(4) |
|
若保持温度不变,开始时向容器B中加入amolN2、bmolH2和1molNH3,平衡时,测得放出的热量为23.1kJ,NH3的体积分数与A容器平衡状态P相同,则a+b的值是________.
|
|
|
查看答案和解析>>
科目:
来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷
题型:022
|
|
发射航天飞机的火箭常用氮的氢化物肼(N2H4)作燃料.试回答下列有关问题:
| (1) |
|
在结构上N2H4和NH3的关系有如H2O2和H2O的关系.N2H4能发生下列反应:
N2H4+H3O+ N2H5++H2O N2H4+H2O N2H5++H2O N2H4+H2O N2H5++OH- N2H5++OH-
N2H5++H2O N2H62++OH- N2H5++H2O N2H62++OH- N2H5++H2O N2H4+H3O+ N2H4+H3O+
据此你可得出的结论是________(填字母).
|
| [ ] |
A. |
肼水解显酸性
|
B. |
肼在水中电离出H+
|
C. |
肼是二元弱碱
|
D. |
肼是二元弱酸
|
|
(2) |
|
液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为________.
|
|
(3) |
|
25℃时,0.2mol·L-1氨水与0.2mol·L-1HCl溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=a(a<7).则混合溶液中由水电离出的c(H+)________(填“大于”、“等于”或“小于”)0.2mol·L-1HCl溶液中电离出的c(H+);混合溶液中,c(H+)-c(NH3·H2O)=________(用含有a的关系式表示).
|
|
|
查看答案和解析>>
科目:
来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷
题型:022
|
|
X通常存在于钢铁中,它是由两种常见元素组成的混合物.A、D、H、I、J常温下为气体,H、I、J为单质.反应①为氯碱工业的主要反应,反应③是制备理想绿色水处理剂Na2FeO4(高铁酸钠)的一种方法(图中部分生成物没有列出).
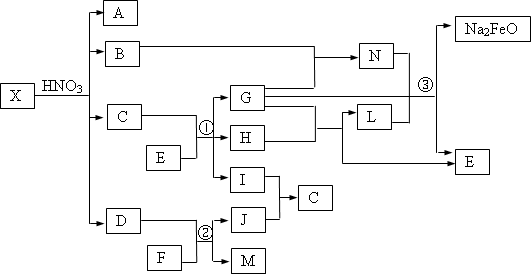
请依据上述物质之间关系回答下列问题:
| (1) |
|
(2) |
|
写出反应②的化学方程式________;反应③的离子方程式________.
|
|
(3) |
|
若X是由组成元素相同的甲和乙的混合物,甲、乙均是由两种元素原子以最简整数比构成的化合物,其相对分子质量分别为124、180.现测得X中组成元素的质量之比为3∶35,则乙在X中的物质的量分数为________.
|
|
|
查看答案和解析>>


