
科目: 来源:增城市2007届高三毕业班综合测试化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:增城市2007届高三毕业班综合测试化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:枣庄市二OO七届高三第一次调研考试、化学试题 题型:022
(1)右表为为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
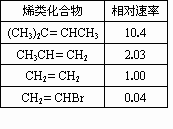
据表中数据,总结烯类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:________
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率快的是________(填代号).
A、(CH3)2C=C(CH3)2
B、CH3CH=CHCH3
C、CH2=CH2
D、CH2=CHCl
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2CH2Br
(主要产物) (次要产物)
CH2=CHCH2CH3+H2O![]() CH3CH(OH)CH2CH3+CH3CH2CH2CH2OH
CH3CH(OH)CH2CH3+CH3CH2CH2CH2OH
(主要产物) (次要产物)
下列框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有4个碳原子、1个溴原子、1种氢原子.
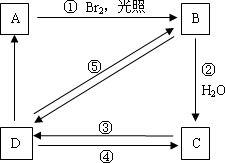
上述框图中,A的结构简式为________;属于取代反应的有________(填框图中序号),写出反应④的化学方程式(只写主要产物,标明反应条件):________.
查看答案和解析>>
科目: 来源:枣庄市二OO七届高三第一次调研考试、化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:枣庄市二OO七届高三第一次调研考试、化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:枣庄市二OO七届高三第一次调研考试、化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:枣庄市二OO七届高三第一次调研考试、化学试题 题型:022
| |||||||||||
查看答案和解析>>
科目: 来源:枣庄市二OO七届高三第一次调研考试、化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:英德中学2007届选择题专项训练5 题型:022
|
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
| |
| [ ] | |
A. |
常压下五种元素的单质中,Z单质的沸点最高 |
B. |
Y、Z的阴离子电子层结构都与R原子的相同 |
C. |
W的氢化物的沸点比X的氢化物的沸点高 |
D. |
Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com