
科目: 来源:2006-2007学年度临沂市高三期末考试化学试题2007.1 题型:022
| |||||||||||||||
查看答案和解析>>
科目: 来源:2006-2007学年度临沂市高三期末考试化学试题2007.1 题型:022
| |||||||||||
查看答案和解析>>
科目: 来源:点击高考中创新性试题、化学 题型:022
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示.
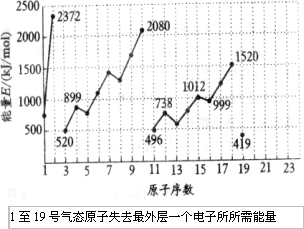
试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题.
(1)同主族内不同元素的E值变化的特点是________.各主族中E值勤的这种变化特点体现了元素性质的________变化规律.
(2)同周期同,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系中正确的是________
①E(砷)>E(硒);②E(砷)<E(硒);③E(溴)>E(硒);④E(溴)<E(硒)
(3)估计mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<________.
(4)10号元素E值较大的原因是________.
查看答案和解析>>
科目: 来源:点击高考中创新性试题、化学 题型:022
如图所示,现在一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅.
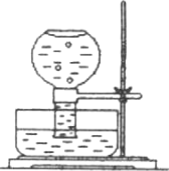
(1)产生上述现象的原因是________(请用相关的反应方程式和简要文字说明).
(2)当氯水中不再产生气泡时,某学生欲检验该反应所产生的气体,则该同学可采取的合理操作是________.
(说明:氯水有一定腐蚀性,操作时需戴手套)
查看答案和解析>>
科目: 来源:江苏省三星高级中学如皋市城西中学2007年四月份月考试卷、化学 题型:022
| |||||||||||
查看答案和解析>>
科目: 来源:江苏省三星高级中学如皋市城西中学2007年四月份月考试卷、化学 题型:022
| |||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省三星高级中学如皋市城西中学2007年四月份月考试卷、化学 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省三星高级中学如皋市城西中学2007年四月份月考试卷、化学 题型:022
| |||||||||||
查看答案和解析>>
科目: 来源:江苏省三星高级中学如皋市城西中学2007年四月份月考试卷、化学 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省三星高级中学如皋市城西中学2007年四月份月考试卷、化学 题型:022
| |||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com