
科目: 来源:潮州市2008年高考第二次模拟测试、化学试题 题型:022
有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大.B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个.甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐.甲、乙、丙、丁四种物质之间的相互反应关系如下图:
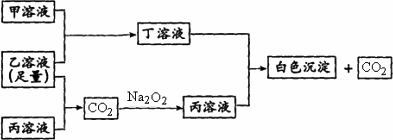
请回答:(1)写出A的最高价的氧化物的电子式________________.
(2)用有关化学用语解释:丙溶液呈碱性的原因________________.
(3)写出有关反应的离子方程式:
①甲溶液+乙溶液:________________;②丁溶液+丙溶液:_____________.
查看答案和解析>>
科目: 来源:2008年中山纪念中学5月份化学模拟试题 题型:022
已知:①卤代烃(R-X)与镁在乙醚中可生成著名的“格氏试剂”:
![]() (格氏试剂)②格氏试剂广泛用于有机合成,如在一定条件下能与醛中的羰基发生加成,生成物又可以发生水解生成醇:
(格氏试剂)②格氏试剂广泛用于有机合成,如在一定条件下能与醛中的羰基发生加成,生成物又可以发生水解生成醇:
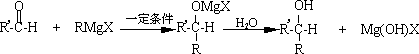
因此上述反应常用于醛合成醇.现要合成![]() ,请回答:
,请回答:
(Ⅰ)所用的醛和卤代烃分别是(写出结构简式)醛:________,卤代烃:________.
(Ⅱ)该醇能使FeCl3溶液显色的同分异构体有________种.
查看答案和解析>>
科目: 来源:2008年中山纪念中学5月份化学模拟试题 题型:022
某有机物的相对分子质量为72.
①若该有机物只含C、H两元素,其分子式为________.
②若该有机物分子中只有一种官能团,且能发生银镜反应,写出可能有的结构简式
________________________________.
③若该有机物分子中有一个羧基,写出该有机物与甲醇发生酯化反应生成物的结构简式
________________________________.
查看答案和解析>>
科目: 来源:2008年中山纪念中学5月份化学模拟试题 题型:022
已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满.D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1.按要求填写
①B的电子排布式是:________,A、B两元素形成的化合物的晶体类型是________.
②D元素单质的晶体类型是________,C单质的制备方法是:________.
③E和F形成的化合物空间构型为________,该物质比D与E形成的化合物更容易液化的原因是________________________.
查看答案和解析>>
科目: 来源:2008年中山纪念中学5月份化学模拟试题 题型:022
人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程.目前中学课本中的酸碱理论是1889年阿仑尼乌斯(Arrhenius)提出的电离理论.
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论.溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱.试写出液氨自身电离的方程式:________________.
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论.凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱.
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是________________.
A、H2O B、NH4+ C、OH- D、HCO3- E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念.凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸.酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O.试指出下列两个反应中的酸或碱:(Ⅰ)H3BO3+H2O![]() H++B(OH)4-,该反应中的碱是________(填H3BO3或H2O);(Ⅱ)NaH+H2O
H++B(OH)4-,该反应中的碱是________(填H3BO3或H2O);(Ⅱ)NaH+H2O![]() NaOH+H2↑,该反应中的酸是________(填NaH或H2O).
NaOH+H2↑,该反应中的酸是________(填NaH或H2O).
查看答案和解析>>
科目: 来源:2008年中山纪念中学5月份化学模拟试题 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山西省实验中学2007-2008学年高三年级第一次月考试题、化学 题型:022
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC________Si;SiCl4________SiO2
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.

(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)该反应的反应热ΔH=________.
Si(s)+4HCl(g)该反应的反应热ΔH=________.
查看答案和解析>>
科目: 来源:山西省实验中学2007-2008学年高三年级第一次月考试题、化学 题型:022
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤.干燥后,沉淀质量为2.33 g.根据上述实验,作出判断:
该溶液中一定存在的是________
该溶液中一定不存在的是________
该溶液中可能存在的是________
查看答案和解析>>
科目: 来源:山西省实验中学2007-2008学年高三年级第一次月考试题、化学 题型:022
用①Na2CO3、②NaOH、③BaCl2、④盐酸作试剂,除去NaCl溶液中含有少量Ca2+、Mg2+和SO42-离子(每种试剂只能使用一次).
加入试剂顺序:________
有关离子反应方程式:
第一步:________
第二步:________
第三步:________
第四步:________
查看答案和解析>>
科目: 来源:北京市海淀区2007~2008学年度高三年级第一学期期中练习、化学试题 题型:022
常温下有浓度均为0.5 mol·L-1的四种溶液:
①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水.
请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是________(填序号,下同),在发生水解反应的溶液中pH最大的是________.
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是________.
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中![]() 的值________(填“增大”或“减小”或“不变”)
的值________(填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
________________________________________________________.
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com