
科目: 来源:江苏省启东市中学2008届高考化学一轮复习周周测 题型:022
下表为元素周期表的一部分,请回答有关问题:
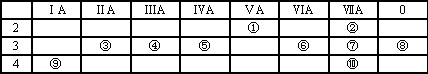
(1)⑤和⑧的元素符号是________和________;
(2)表中最活泼的金属是________,非金属最强的元素是________;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:_____________________,_____________________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:___________________.
查看答案和解析>>
科目: 来源:江苏省南海中学2008届高三化学第一次月考试题 题型:022
某工厂废液中含有大量Ag+、Fe3+、Al3+,用下列图示方法进行分离利用(部分反应条件省略):(已知试剂z是医药工业中常用的有甜味的白色晶体)
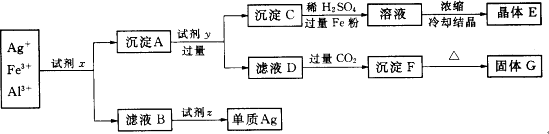
(1)写出下列物质的化学式:
试剂x________、试剂z________、晶体E________、固体G________.
(2)写出下列反应的离子方程式:
沉淀A+试剂y:___________;滤液D+过量CO2:_______________________
查看答案和解析>>
科目: 来源:江苏省南海中学2008届高三化学第一次月考试题 题型:022
某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等.工业流程图如下图(框图中水省略):

请回答:
(1)Y的名称是________、Z的化学式为________.
(2)他们的主要产品中的元素在周期表中,锌属________族,X在________周期.
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为________.
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐.如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式:__________.
(5)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解.对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点:_______________________________.
查看答案和解析>>
科目: 来源:江苏省南海中学2008届高三化学第一次月考试题 题型:022
过氧化氢(H2O2)是一种无色透明粘稠状液体,它的水溶液俗称双氧水,呈弱酸性,一种强氧化剂,漂白剂,消毒剂,是生产过氧化物的原料.
(1)写出H2O2的电子式_________________,
(2)H2O2与强碱反应可生成正盐,一定条件下也生成酸式盐,写出NaOH与H2O2反应生成酸式盐的化学方程式:____________________.
(3)在H2O2中加入少量苯,再滴人数滴K2Cr2O7的硫酸溶液,振荡静置,苯层呈蓝色,这是由于反应生成过氧化铬(CrO5)溶于苯的缘故,已知过氧化铬的结构式为:①写出该反应的离子方程式:________________
②这个反应是否是氧化还原反应?________,其理由是________
(4)双氧水属于________(A强电解质、B弱电解质、C非电解质、D以上都错),它被称为“绿色氧化剂”,理由是__________________________________.
查看答案和解析>>
科目: 来源:江苏省南海中学2008届高三化学第一次月考试题 题型:022
某学生为了测定某稀硫酸的物质的量浓度,用不同质量的纯锌粉与该硫酸进行反应.他的六次实验结果如下(计算结果精确到0.1):
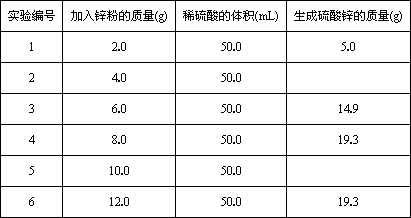
(1)第2、第5组两实验中生成硫酸锌的质量分别是________g和________g.
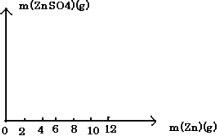
(2)请在下图中画出生成硫酸锌的质量[m(ZnSO4)]与加入锌粉的质量[m(Zn)]的关系图(需要标明关键点的横坐标和纵坐标).
(3)若使(10+m)g锌粉与50.0 mL上述稀硫酸充分反应,剩余固体的质量为________g;该稀硫酸的物质的量浓度为________mol/L.
查看答案和解析>>
科目: 来源:江苏省淮阴中学2008届高三第二次月考试卷化学试题 题型:022
实验室现有下列药品:
固体药品:A、消石灰 B、氯化钠 C、二氧化锰 D、氯酸钾 E、铜
液体药品:a、浓盐酸 b、过氧化氢 c、饱和食盐水 d、浓硫酸 e、浓硝酸 f、氯酸钾.
请选择合适的试剂制取下列气体:
(1)制取O2化学反应方程式是:________________________.
(2)制取Cl2化学反应方程式是:________________________.
(3)制取HCl化学反应方程式是:________________________.
(4)制取NO2化学反应方程式是:________________________.
查看答案和解析>>
科目: 来源:江苏省淮阴中学2008届高三第二次月考试卷化学试题 题型:022
X,Y,A,B,C,D是中学化学教材中常见的物质,且有图示的转化关系.气体C的式量比气体X的式量大2,D的焰色反应呈黄色,产物中水已忽略.
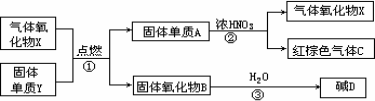
(1)写出有关物质的化学式:X________ Y________ A________ B________ C________ D________
(2)反应①的反应类型是(填基本反应类型)________________________________.
(3)物质B的主要用途是_______________________________________________.
(4)反应②的化学方程式为:____________________________________________.
查看答案和解析>>
科目: 来源:江苏省淮阴中学2008届高三第二次月考试卷化学试题 题型:022
| |||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省高淳高级中学2008届高三质量检测化学试卷 题型:022
(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示:
则苯氯乙酮不可能具有的化学性质是________(填字母序号).
a.加成反应 b.取代反应 c.消去反应 d.水解反应 e.银镜反应
(2)今有化合物

①请写出丙中含氧官能团的名称:________________;
②请判别上述哪些化合物互为同分异构体:________________;
③请按酸性由强至弱排列甲、乙、丙的顺序:________________;
(3)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料.

①丙烯分子中,最多有________个原子在同一个平面上;
②聚合物F的结构简式:________;
③B转化为C的化学方程式:________________________;
④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式:________________.
查看答案和解析>>
科目: 来源:江苏省高淳高级中学2008届高三质量检测化学试卷 题型:022
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=________,升高温度,K值________(填“增大”、“减小”或“不变”);
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(填字母序号).
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com