
科目: 来源:江西吉安一中2007-2008学年度上学期高三第一次段考化学试卷 题型:022
图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜为“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过,而阻止阴离子和气体通过.
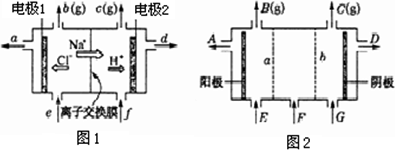
(1)电解后得到的氢氧化钠溶液从________口流出(填字母代号),b口排出的是________气体,电极1应连接电源的________极(填“正”或“负”);理论上讲,从f口加入纯水即可,但实际生产中,纯水要加入一定量的NaOH溶液,其原因是_________________和_________________.
(2)图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置.请回答:a为________(填“阳”或“阴”)离子交换膜;从E口流进的物质的化学式(若为溶液,则写出溶质的化学式)___________________.
查看答案和解析>>
科目: 来源:江西吉安一中2007-2008学年度上学期高三第一次段考化学试卷 题型:022
A、B、C、D是四种可溶于水的物质,它们分别由下列阴离子与阳离子两两组合而成,每种离子只能使用一次.
将A、B、C、D四种物质溶液两两混合(必要时,有的实验进行加热)其实验现象如下:
①将B溶液和C溶液混合产生白色沉淀,白色沉淀不溶于酸.
②将A溶液和D溶液混合产生白色沉淀,同时有气体生成.
③将A溶液和B溶液混合产生白色沉淀,同时有气体生成.
那么A、B、C、D分别为________、________、________、________.
查看答案和解析>>
科目: 来源:江西吉安一中2007-2008学年度上学期高三第一次段考化学试卷 题型:022
常温下在20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液的PH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示
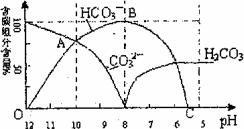
回答下列问题:
(1)在0.1mol/L Na2CO3溶液所有阳离子和阴离子的浓度有何关系?(用等式表示)___________.
(2)当加入盐酸使溶液PH值为10时,混合液中含碳元素的离子物质的量之比为________.
(3)随着盐酸的加入,请写出BC段的离子方程式______________.
(4)当混合液的PH=________时,开始放出CO2气体.
查看答案和解析>>
科目: 来源:江苏省众兴中学2008届高三第三次调研考试、化学 题型:022
A、B、C、D四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、、CO32-中的一种.
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色.
(2)若向(1)的四支试管中分别加入盐酸,B盐溶液有沉淀生成,D盐溶液有五色无味的气体逸出.根据(1)、(2)实验事实可推断它们的化学式为:
A________B________C________D________.
写出盐酸与D反应的离子反应方程式:________________________.
查看答案和解析>>
科目: 来源:江苏省众兴中学2008届高三第三次调研考试、化学 题型:022
中学化学中几种常见物质的转化关系如下:
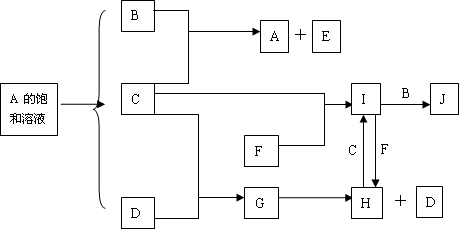
C,D为常见的气体单质,C为黄绿色,D为无色气体.F为一种常用的金属单质,J是一种红褐色的沉淀,反应①是重要的化工生产中的反应.E的焰色反应为黄色.
将I溶液滴入沸水中可得到以J为分散质的红褐色胶体.请回答下列问题:
(1)红褐色胶体J粒子直径大小的范围:______________
(2)A、B、C、F、H的化学式:A________,B________,C________,F________,H________
(3)①写出反应①的离子方程式:________.
②写出反应I→J的离子方程式:________.
(4)写出鉴定I中阳离子的实验方法和现象:____________________
查看答案和解析>>
科目: 来源:江苏省众兴中学2008届高三第三次调研考试、化学 题型:022
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯.其变化可表述为:
aKClO3+bHCl(浓)——cKCl+dClO2+eCl2↑+fH2O
(1)浓盐酸在反应中显示出来的性质________、________;还原产物为________.
(2)根据Cl元素守恒得a、b、c、d、e的关系式为________________________.
(3)产生2 mol ClO2,则转移的电子的物质的量为____________mol.
(4)写出该反应的离子方程式________________________________.
查看答案和解析>>
科目: 来源:江苏省扬中市高级中学2007-2008届一轮复习化学平衡 题型:022
有甲、乙两个容积相等的恒容密闭容器,向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B和3 molC和2 mol D,将两容器的温度恒定在770K,使反应3A(g)+B(g)![]() xC(g)+D(s)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g)+D(s)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=________;若平衡时,甲、乙两容器中A的物质的量不相等,则x=________.
(2)平衡时甲、乙两容器中A、B的物质的量之比是否相等________(填“相等”或“不相等”),平衡时甲中A的体积分数为________.
(3)若平衡时,甲、乙两容器中A的物质的量相等,改为按不同配比作为乙的起始物质,达到平衡后,C的体积分数都仍为0.2.
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是________
②若加入0.6 mol A和0.2 mol B,则C和D起始物质的量分别应满足________,________
(4)若平衡时两容器中的压强不相等,则两容器中压强之比为________.
查看答案和解析>>
科目: 来源:江苏省扬中市高级中学2007-2008届一轮复习化学平衡 题型:022
如图1,将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0.当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol.
2SO3(g);ΔH<0.当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol.
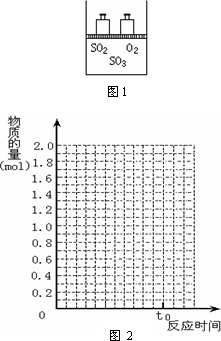
试回答:
(1)在图2中作出反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线;
(2)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2(T2>T1),反应在t3时间时(t3>t1)重新达到平衡状态,新平衡混合物中气体的总物质的量________2.1 mol(填“<”、“>”或“=”).
(3)若起始时加入0.6 mol SO2、0.3 mol O2和x mol SO3,保持温度不变,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的值为________.
查看答案和解析>>
科目: 来源:江苏省扬中市高级中学2007-2008届一轮复习化学平衡 题型:022
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同.(已知:2NO2![]() N2O4;ΔH<0)
N2O4;ΔH<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA________VB.(填“>”、“<、“=”);若打开活塞K2,气球B将________(填:变大、变小、不变).
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填增大或减小、不变);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将________(填:变大、变小、不变).
查看答案和解析>>
科目: 来源:江苏省扬中高级中学2007-2008届高三化学第二次月考化学试卷 题型:022
物质A、D及F的水溶液均呈黄色,D是单质,F的溶液遇苯酚显紫色,A是一种重要工业生产中的主要原料.且A、C、D均含有某一非金属元素,C的相对分子质量与过氧化氢的相对分子质量相等.反应过程中生成的水等与转化无关的物质已经略去.这些物质有以下转化关系.试回答以下问题:
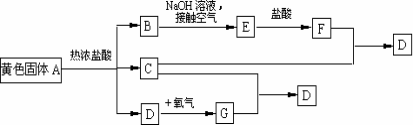
(1)A是___________,C是___________,F是___________(均填化学式).
(2)A与热盐酸反应的离子方程式为_________________________________
(3)写出该框图中由B→E的化学方程式______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com