
科目: 来源:深圳外国语学校2008届高三年级第二次质量检测化学试题 题型:022
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸.
(1)请写出并配平上述反应的化学方程式________.
(2)此反应的还原剂是________,它的氧化产物是________.
(3)此反应的离子反应方程式可表示为:________.
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还可能有(填一种)________.
查看答案和解析>>
科目: 来源:山西省实验中学2008届高三年级第一次月考化学试题 题型:022
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC________Si;SiCl4________SiO2
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
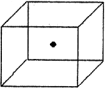
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热ΔH=________
查看答案和解析>>
科目: 来源:荣达高考复读学校2008届高三第二次质量检测化学试卷 题型:022
由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略):
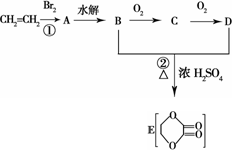
请分析后回答下列问题:
(1)反应的类型分别是①________、②________;
(2)D物质中的官能团为________;
(3)C物质的结构简式________,物质X与A互为同分异构体,则X的结构简式为________,X的名称为________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式________
查看答案和解析>>
科目: 来源:荣达高考复读学校2008届高三第二次质量检测化学试卷 题型:022
将5.1 g镁铝合金溶于600 mL 0.5 mol·L-1 H2SO4溶液中,完全溶解后再加入1.0 mol·L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少.
(1)当加入________mL NaOH溶液时,可使溶解在硫酸中的Mg2+和Al3+恰好完全沉淀.
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积.(列出算式)________
查看答案和解析>>
科目: 来源:荣达高考复读学校2008届高三第二次质量检测化学试卷 题型:022
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO![]() 、SO
、SO![]() 、Cl-、I-、HCO
、Cl-、I-、HCO![]() ,取该溶液实验如下:
,取该溶液实验如下:
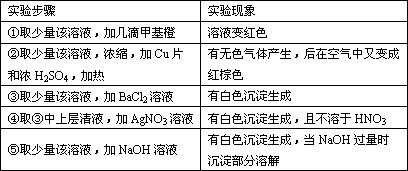
(1)溶液中肯定存在的离子是________.
(2)溶液中肯定不存在的离子是________.
(3)为进一步确定其他离子,应该补充的实验是________.
查看答案和解析>>
科目: 来源:南昌二中2008届高三第一次考试化学试卷 题型:022
A、B、C、D是四种可溶的化合物,分别由阳离子K+、Al3+、Ba2+、Fe3+和阴离子OH-、CO32-、SO42-、NO3-两两组合而成,它们的溶液发生如下反应:
A与B反应生成白色沉淀,再加过量A,沉淀量减少但不会完全消失;C与D反应生成有色沉淀;B与C反应生成白色沉淀.写出它们的化学式:
A________ B________
C________ D________
查看答案和解析>>
科目: 来源:南昌二中2008届高三第一次考试化学试卷 题型:022
甲、乙两池电极材料都是铁棒与碳棒.请回答下列问题:
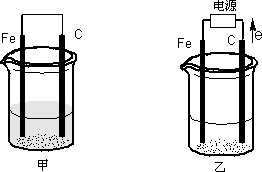
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒.
②在乙池中阳极的电极反应式是________.
(2)若两池中均为饱和NaCl溶液.
①写出乙池中总反应的离子方程式________.
②甲池中碳极上电极反应式是________.乙池碳极上电池反应属于________(填氧化或还原)反应.
③将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化.若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸.该反应的化学方程式为________.
④若乙池转移0.02 mol电子后停止实验,池中溶液的体积是200 ml,则溶液混匀后的pH=________.
查看答案和解析>>
科目: 来源:南昌二中2008届高三第一次考试化学试卷 题型:022
接触法制硫酸的某阶段的反应为:2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196.64kJ/mol.
2SO3(g);ΔH=-196.64kJ/mol.
(1)该反应在________(填一种设备)中进行,这种设备中部的装置叫________,其作用是________________.
(2)在实际生产中,为实现较快的反应速率及较大的转化率,采用的条件是________.
(3)在上述条件下,将1 mol SO2和0.5 mol O2充入某密闭容器中,放出的热量________(填“大于”、“小于”或“等于”)98.32 kJ.
(4)实验室用4 mol SO2与2 mol O2进行上述反应,当放出314.624 KJ热量时,SO2的转化率为________.
查看答案和解析>>
科目: 来源:江西吉安一中2007-2008学年度上学期高三第一次段考化学试卷 题型:022
已知:①A、B、C为常见的单质,且单质B、C的元素同一主族,单质B、C的相对分子质量相等;
②F为正盐,B和I为气体且B无气味;
③沉淀H既可溶于盐酸又可溶于NaOH溶液,D、E的相对分子质量与H相同,向一定量的F溶液中逐渐加入固体粉末D或E,当D或E与F以物质的量之比3∶1反应时,生成的沉淀H的量最多.其物质间的转化关系如下:
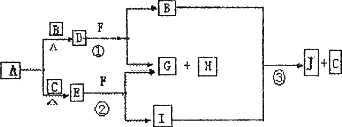
(1)写出D的电子式__________________,E的化学式__________________.
(2)写出反应①的离子反应方程式__________________.
写出反应②的离子反应方程式__________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com