
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-碳硅及其化合物 题型:022
(1)课本上叙述:“……碳、硅、锗、锡的+4价化合物是稳定的.而铅的+2价化合物是稳定的.”据此判断:锡的+2价化合物(如SnCl2)应具有较强的(填“氧化”或“还原”下同)________性,铅的+4价化合物应具有较强的________性.PbO2与浓盐酸可发生氧化还原反应生成Cl2,该反应的化学方程式为________.
(2)我国古代炼丹中经常使用到红丹,俗称铅丹.在一定条件下铅丹(用X表示)与硝酸能发生如下反应:X+4HNO3![]() PbO2+2Pb(NO3)2+2H2O.
PbO2+2Pb(NO3)2+2H2O.
铅丹的化学式是________,此铅丹中铅的化合价是________.
由此反应可推测PbO是(填“酸”或“碱”,下同)________性氧化物,PbO2是________性氧化物.
(3)砷酸钠在酸性条件下跟碘化钾溶液反应生成亚砷酸钠(Na3AsO3)、碘单质和水的离子反应方程式是________上述反应中电子转移数目是________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-实验基础(3) 题型:022
欲用98%的浓硫酸(ρ=1.84 g/cm)配制成浓度为0.5 mol/L的稀硫酸500 mL.
(1)主要仪器有:量筒、烧杯、玻璃棒、________、________.
(2)简要回答下列问题:
①所需浓硫酸的体积为________;
②如果实验室有15 mL、20 mL、50 mL的量筒应选用________mL的最筒最好.
③在转入容量瓶前烧杯中液体应冷却至室温,否则会使结果浓度偏________.(填“高”、“低”、下同)
④定容时必须使溶液的凹液面的最低点与刻度相平,若俯视会使结果浓度偏________
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-实验基础(2) 题型:022
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
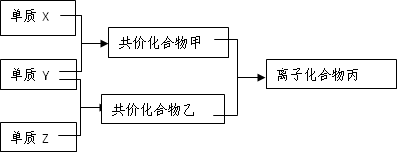
已知:a.常见双原子单质分子中,X分子含共价键最多,键能很大.b.甲分子中含10个电子,乙分子含有18个电子.
(1)X的电子式是________.
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲.
①在图中方框内绘出用烧瓶收集甲的仪器装置简图.
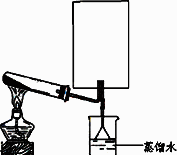
②试管中的试剂是(填写化学式)________.
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-溶解平衡与溶解度 题型:022
回答下列有关常数的问题
(1)Kw的数学表达式是Kw=________,温度升高Kw的变化情况是________(选填“变大”、“变小”或“不变”),若定义pOH=-lgc(OH-),则pH+pOH=________(用含Kw的代数式表示)
(2)K通常表示化学平衡常数,K值越大表示该反应进行得越________,对于反应2NO2(g)![]() N2O4(g),其化学平衡常K的数学表达式为________.
N2O4(g),其化学平衡常K的数学表达式为________.
(3)Ka通常表示弱酸的电离平衡常数,Ka值越大表示该弱酸________,α通常称为电离度,顾名思义是表示弱电解质的电离程度大小的一个指标,对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Ka的变化情况是________(选填“变大”、“变小”或“不变”),α的变化情况是________(选填“变大”、“变小”或“不变”).
(4)Ksp表示难溶物的溶度积常数,该常数越大表示________.
(5)已知CO(g)+2H2(g)![]() CH3OH(g)某温度时,向一定容积的密闭容器中充入CO和H2,浓度分别为1 mol·L-1、2 mol·L-1,达到平衡时CO的浓度为0.6 mol·L-1.试求该温度下的化学平衡常数.
CH3OH(g)某温度时,向一定容积的密闭容器中充入CO和H2,浓度分别为1 mol·L-1、2 mol·L-1,达到平衡时CO的浓度为0.6 mol·L-1.试求该温度下的化学平衡常数.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-溶解平衡与溶解度 题型:022
进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡.已知25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10
(1)Ba2+是有毒的重金属离子,当人体中Ba2+浓度达到2×10-3 mol·L-1时,就会对健康产生危害,若有人误将氯化钡当做食盐食用,请通过计算说明是否可以服用5%的硫酸钠溶液有效除去胃中的Ba2+.(注:5%的硫酸钠溶液物质的量浓度约0.36 mol·L-1)
(2)25℃时,已知胃液的PH在0.9-1.5之间,请问________(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-溶解平衡与溶解度 题型:022
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)].

(1)正常海水(Cl-的浓度大于0.1 mol/L)中汞元素的主要存在形态是________.少量Hg(NO3)2溶于0.001 mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是________.
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是________(用离子方程式表示),为了防止出现浑浊,可采取的措施是________.
(3)处理含汞废水的方法很多.下面是常用的两种方法,汞的回收率很高.
①置换法:用废铜屑处理含Hg2+的废水.反应的离子方程式为________.
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀.已知:
Ksp(HgS)=1.6×10-52,当废水中c(S2-)=1×10-5 mol/L时,c(Hg2+)=________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-镁铝及其化合物 题型:022
取agNa2O2与Al粉组成的混合物,投入适量的水中,固体完全溶解,在标准状况下放出气体VL(设产生的气体全部放出).
(1)有关反应的化学方程式为:________,________.
(2)若VL气体点燃时恰好完全反应,则原混合物中Na2O2与Al的物质的量之比是________.
(3)V的取值范围是________(用含a的代数式表示,可不约简).
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-镁铝及其化合物 题型:022
置换反应的通式可以表示为:
单质(1)+化合物(1)=化合物(2)+单质(2)
请根据下列条件:①所涉及的元素的原子序数都小于18;②6种单质分别属6个不同的主族.写出满足上述要求的3个置换反应的化学方程式:
(1)________;
(2)________;
(3)________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-硫及其化合物 题型:022
表中所列是周期表ⅥA族(氧族元素)的主要元素,表中内容为该族元素的部分性质.

请根据表回答下列问题:
(1)硒的熔点范围可能是________;
(2)碲的化合价可能有________;
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是________(填化学式);
(4)氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为________;
(5)已知在常温下,生成17 g H2S放出56.1 KJ的热量,试写出硫化氢分解的热化学方程式:________;
(6)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,ΔH为相同物质的量的单质与H2反应的反应热.则:b代表________,d代表________(均写单质名称).
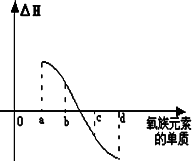
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-硫及其化合物 题型:022
硫酸铝铵[NH4Al(SO4)2]溶于水能电离出NH4+、Al3+和SO42-.往硫酸铝铵溶液中滴加过量NaOH溶液并加热,写出反应的离子方程式:________.
往硫酸铝铵溶液中滴加过量Ba(OH)2溶液并加热,写出反应的离子方程式:
________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com